Repositorio de Artículos | Congreso Virtual Internacional de Psiquiatría, Psicología y Salud Mental (Interpsiquis) | VI Edición | 2005
Tasa de olvido en tareas de memoria verbal y no verbal en la Enfermedad de Alzheimer precoz.
Autor/autores: Francisco Ramos Campos
RESUMEN
Objetivo: Comparar la tasa de olvido de información en tareas de memoria verbal y no verbal en sujetos con enfermedad de Alzheimer precoz (EAD) y sujetos sanos control (SC)
Método: La muestra se compone de 28 sujetos. 14 sujetos con probable EAD según criterios NINDS-ADRAD (media edad=74, 3; 3 varones y 11 mujeres) en fase muy leve CDR (0, 5; Hudges et al, 1982) y 14 SC (media edad = 71, 50; 5 varones y 9 mujeres). Las pruebas neuropsicológicas aplicadas fueron: Mini Mental Status Examination (MMSE; Folstein et al. , 1975), escala de demencia de Mattis (DRS-2; Juricca et al, 2001), Test del reloj (TR; Cacho et al. , 1999), Test de aprendizaje verbal de Hopkins (TAVH; Benedict et al. , 1998) y Test de memoria espacial secuencial (MES; Contador et al. , 2004)
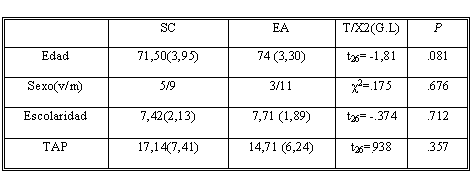
Resultados: Los grupos estuvieron equiparados en edad (p =. 08), sexo (p =. 676), años de escolaridad (p =. 712) e inteligencia premórbida (p = . 357). Existieron diferencias significativas entre el grupo EAD y SC en: MMSE (p <. 001), DRS-2 (p <. 001), TR (p <. 001) y en la tasa de olvido de palabras (p <. 001) entre EAD y SC, sin embargo tales diferencias no se dieron en la tasa de olvido de información no verbal (p<. 206).
Conclusión: El déficit de memoria no verbal en la EAD no puede explicarse por un déficit en el mecanismo de consolidación de la información sino más bien por un déficit en la adquisición de la información.
Palabras clave: Alzheimer
Tipo de trabajo: Conferencia
Área temática: Neurocognitivos, Trastornos neurocognitivos .
Tasa de olvido en tareas de memoria verbal y no verbal en la enfermedad de Alzheimer precoz.
Bernardino Fernández Calvo; Israel Contador Castillo; Jesus Laureano Cacho Gutierrez; Francisco Ramos Campos; Silvia Gamazo Navarro.
Hospital Clinico Universitario-Universidad de Salamanca.
Resumen
Objetivo: Comparar la tasa de olvido de información en tareas de memoria verbal y no verbal en sujetos con enfermedad de Alzheimer precoz (EAD) y sujetos sanos control (SC) Método: La muestra se compone de 28 sujetos. 14 sujetos con probable EAD según criterios NINDS-ADRAD (media edad=74, 3; 3 varones y 11 mujeres) en fase muy leve CDR (0, 5; Hudges et al, 1982) y 14 SC (media edad = 71, 50; 5 varones y 9 mujeres). Las pruebas neuropsicológicas aplicadas fueron: Mini Mental Status Examination (MMSE; Folstein et al. , 1975), escala de demencia de Mattis (DRS-2; Juricca et al, 2001), Test del reloj (TR; Cacho et al. , 1999), Test de aprendizaje verbal de Hopkins (TAVH; Benedict et al. , 1998) y Test de memoria espacial secuencial (MES; Contador et al. , 2004) Resultados: Los grupos estuvieron equiparados en edad (p =. 08), sexo (p =. 676), años de escolaridad (p =. 712) e inteligencia premórbida (p = . 357). Existieron diferencias significativas entre el grupo EAD y SC en: MMSE (p <. 001), DRS-2 (p <. 001), TR (p <. 001) y en la tasa de olvido de palabras (p <. 001) entre EAD y SC, sin embargo tales diferencias no se dieron en la tasa de olvido de información no verbal (p<. 206). Conclusión: El déficit de memoria no verbal en la EAD no puede explicarse por un déficit en el mecanismo de consolidación de la información sino más bien por un déficit en la adquisición de la información.
Introducción
La enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa de etiología desconocida e inicio insidioso caracterizada por múltiples déficit cognitivos [1]. La perdida de memoria es de manera frecuente el primer síntoma que aparece en la enfermedad [2].
Teniendo en cuenta que la alteración neuropsicológica de la memoria (amnesia) es la condición sine qua non para poder establecer el diagnóstico clínico de demencia [2-3], el estudio de la memoria, en los últimos 10 años, se ha convertido en un área de interés fundamental para el diagnóstico precoz de la enfermedad de Alzheimer.
En esta línea, la investigación en memoria sobre el material verbal (MV) ha tenido un gran peso en la investigación básica y clínica [4], sin embargo el funcionamiento de la agenda visoespacial y en concreto la utilidad clínica de la memoria no verbal (MNV) han tenido una menor repercusión en el estudio de la memoria tanto normal como patológica [5], siendo un área casi desconocida en la actualidad [6].
La MNV es definida en términos de la información visoespacial, en cuanto a la habilidad para almacenar y recuperar material de patrones visuales o espaciales complejos que no puede ser asignado un nombre o denominación con facilidad [7].
A pesar de que los déficit de memoria en la enfermedad de Alzheimer han sido documentados tanto para el material verbal como no verbal a nivel inmediato y demorado [8-14], el mecanismo responsable de la disminución en el rendimiento en las tareas de memoria, ya sea de codificación, almacenamiento y recuperación, no ha sido explicado con claridad y si éste déficit a su vez depende del material ya sea verbal o no verbal.
De tal modo, la habilidad para aprender y retener información verbal después de un periodo de tiempo (recuerdo demorado) medida mediante tareas de recuerdo libre ha sido una de las medidas más sensibles para diferenciar entre pacientes con EA temprana y ancianos sanos [15]. Por tanto, a pesar de que el déficit también ha sido contrastado tanto en recuerdo con claves [16] y reconocimiento [17], uno de los problemas más contrastados en la EA temprana esta asociado al almacenamiento de la información a largo plazo con una tasa de olvido rápida en la información [18].
Paralelamente, otros estudios, han estudiado la retención y tasa de olvido en tareas de información visoespacial no verbal. Mientras que algunos resultados, apuntan a un deterioro en la MNV como consecuencia de un problema en la caída del trazo de memoria-almacenamiento a largo plazo, donde las medidas demoradas están especialmente afectadas [14], otros autores, sin embargo, refieren que el deterioro de la MNV se debe más a un problema en la adquisición o codificación del material con tasas de olvido normales [19] o especialmente acentuadas, especialmente en los primeros segundos de retención tras la exposición de los estímulos [20-21].
Los resultados sobre la tasa de olvido dependen en cierta medida del procedimiento utilizado. Mientras algunos autores resaltan el efecto del aprendizaje inicial en la curva de olvido de información [22], otros por el contrario consideran la variable aprendizaje como independiente a la tasa de caída de la información [19]. Además, el sistema de medida de la tasa de olvido ha introducido variabilidad en los resultados. Mientras algunos estudios miden la interacción entre el aprendizaje del grupo y el intervalo de retención [23], este análisis no permite diferenciar la influencia de la escala de medida ni los procesos de memoria que subyacen [24]. En esta línea, tampoco existe acuerdo sobre el tiempo de intervalo para estudiar el olvido de información y los mecanismos específicos asociados a cada intervalo [25]. Finalmente, tareas clásicamente utilizadas en este tipo de estudios han sido medidas reconocimiento, sin embargo algunas investigaciones demuestran que las tareas ya sea de reconocimiento o recuerdo y el tipo de material afectan de forma diferencial a los resultados de la tasa de olvido. De tal forma, sólo existieron diferencias en la tasa de olvido en la tarea de recuerdo libre de figuras abstractas, mientras las medidas de reconocimiento de dibujos y palabras no demuestran una mayor tasa de olvido entre EA y SC [26].
Por tanto, de acuerdo a este planteamiento, queremos estudiar el rendimiento en tareas de recuerdo audio verbal de palabras y no verbal sobre las posiciones de primas en un tablero, comparando las tasas de olvido de información de sujetos con enfermedad de Alzheimer precoz (EA) y sujetos sanos control (SC).
Participantes y Método.
Participantes. Un total de 28 sujetos fueron evaluados en la unidad de demencias y trastornos del comportamiento de la sección de neurología del hospital Universitario de Salamanca. La muestra estaba compuesta por dos grupos: (1) 14 sujetos sanos control (SC). (2) 14 pacientes con enfermedad de Alzheimer (EA). Todos los sujetos dieron su consentimiento informado para participar en el estudio.
El diagnóstico de demencia se realizó según criterios DSM-IV [3] y el de EA de acuerdo con los criterios de NINCDS (National Institute of Neurological and Communicative Disorders and Stroke) y the Alzheimer’s Disease and Related Disorders Association Stroke (ADRDA)[2], siendo incluidos únicamente los pacientes que cumplían los criterios de “probable” demencia tipo Alzheimer y que tenía un grado de demencia cuestionable (0, 5) o leve (1) de acuerdo a la escala de la intensidad de la demencia (CDR)[27]
Todos los pacientes estaban exentos de signos de déficit focal en la exploración neurológica, menos de cuatro puntos en la escala de Hachinski [28] y no existieron lesiones focales en la TAC o RM cerebral, que permiten descartar la presencia de pacientes con enfermedades vasculares en la muestra.
El grupo de SC estaba formado por sujetos sanos sin deterioro cognitivo, no institucionalizados con una vida independiente y con habilidades tanto básicas como instrumentales de la vida diaria intactas. Todos los sujetos control obtuvieron puntuación superiores o igual a 26 puntos en el Mini Mental State Examination (MMSE) de Folstein, Folstein y McHugh [29] y 134 puntos en la escala de valoración de la demencia de Mattis (DRS-2) [30] Fueron excluidos de la muestra todos aquellos participantes historia de traumatismo craneal grave, alcoholismo y antecedentes de trastorno mental grave (e. g. esquizofrenia, depresión). También fueron eliminados sujetos analfabetos, en tratamiento farmacológico y/o con algún tipo de deterioro físico e intelectual que impida o dificulte la realización de las pruebas.
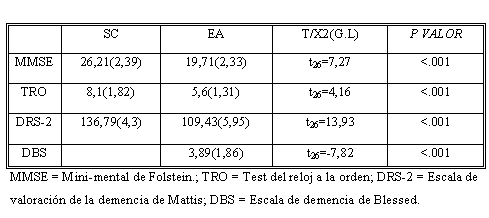
Las características sociodemográficas son presentadas en la tabla 1. Ambos grupos estuvieron equiparados en cuanto a edad, sexo, años de escolaridad y nivel previo de inteligencia medido a través del TAP-test de acentuación de palabras [31]
Tabla 1. Diferencias sociodemogr¡§¢ficas entre los grupos SC y EA
Instrumentos. Todos los pacientes fueron sometidos a una evaluación diagnóstica protocolizada por un único neurólogo. Asimismo, todos los pacientes del estudio han sido explorados neuropsicológicamente. La exploración fue realizada por un sólo neuropsicólogo mediante un protocolo que incluía test simples de cribado cognitivo o “screening”: MMSE de Folstein, Folstein y McHugh en su versión original [29] y el test del reloj a la orden [32]. Además, se aplicaron la escala de valoración de la demencia DRS-2 [30], CDR [27] y como prueba funcional la subescala de deterioro funcional en la demencia de Blessed et al [33]. A través del TAP estimamos la inteligencia previa de los sujetos. [31]
Finalmente incluimos dos pruebas específicas para valorar la memoria verbal y no verbal: test de aprendizaje verbal de Hopkins revisado y adaptado (TAVH-RA) [34] y test de memoria espacial secuencial (MES) [35]
Evaluación de la memoria verbal. Test de aprendizaje audio-verbal de Hopkins revisado-adaptado (TAVH-RA) El objetivo del test es medir memoria anterógrada inmediata y diferida, la curva de aprendizaje, la tasa de olvido y recuerdo facilitado (recuerdo con clave y reconocimiento). El experimentador lee al sujeto una lista de 12 palabras (aplicamos la Forma 1: “animales de cuatro patas, piedras preciosas y moradas humanas”), con una latencia de una palabra cada dos segundos y después se le pide al sujeto que evoque las que recuerde. Se repite el procedimiento sobre un total de tres ensayos. Después de los ensayos de recuerdo libre se facilita al sujeto el recuerdo a través de pautas semántica y finalmente se termina con una tarea de reconocimiento. Este procedimiento se repite a los veinte y cinco minutos sin ensayo de aprendizaje.
Evaluación de la memoria visoespacial. Test de memoria espacial secuencial (MES) La tarea fue diseñada con el objetivo de medir la memoria espacial simultánea no verbal donde los estímulos son presentados al mismo tiempo.
La tarea consta de 9 primas (6 x 1 x 1 cm) y un tablero 25 cm compuesto de 6 x 4 celdas con una dimensión de 3, 5 x 3, 5 cm cada una.
El examinador situado delante del sujeto coloca los nueve prismas en una determinada posición. Mientras que se colocaban las fichas había una barrera que impedía visualizar como se colocaban las fichas. Una vez colocados los prismas se retiraba la barrera que impedía al sujeto observar la colocación de los prismas y se presentaba la configuración durante 10 segundos.
Posteriormente se retiraban las fichas y se decía al sujeto que colocara cada prisma exactamente en la misma posición que habían sido colocadas anteriormente. Éste procedimiento se repitió sobre un total de tres ensayos inmediatos y uno demorado a los veinte y cinco minutos sin exposición previa de la posición. También se obtuvo una medida de reconocimiento inmediato y demorado al colocarle al sujeto las fichas tal y como se la habíamos presentado y le preguntamos si las fichas habían sido colocadas así previamente.
Puntuaciones. Test de Hopkins: Como medidas a analizar hemos tomado las puntuaciones de las pruebas de memoria inmediata en el tercer ensayo, puntuaciones de memoria diferida (ensayo cuarto). Se calculó la tasa de olvido en función de la información mantenida respecto al tercer ensayo-índice de aprendizaje demorado (puntuación en cuarto ensayo entre el ensayo tercero por cien).
Test de primas: Las medidas obtenidas fueron los aciertos (A) en el ensayo tercero y ensayo demorado. Se calculó la tasa de olvido en función de la información mantenida respecto al tercer ensayo-índice de aprendizaje demorado (aciertos en el demorado entre el tercer ensayo y por cien).
Análisis estadísticos Se utilizaron contrastes t de diferencia de medidas para muestras independientes y contrastes X2 para valores nominales.
Resultados
En la tabla 2 se muestran los resultados obtenidos por los diferentes grupos en los test de cribado cognitivo y funcional.
Tabla 2. Diferencias en pruebas de rastreo cognitivo y funcional de los grupos
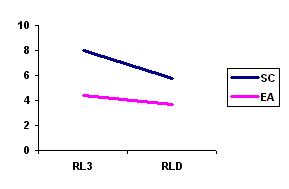
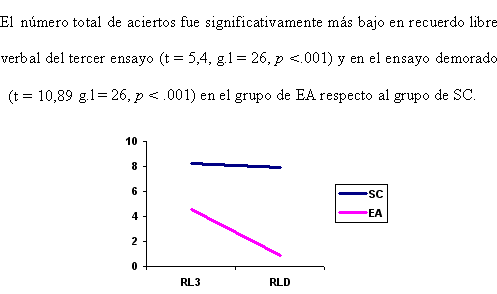
Figura 1. Diferencias en tercer ensayo (RL3) y recuerdo libre demorado (RLD) de la tarea verbal entre los grupos SC y EA.
Asimismo, existieron diferencias estadísticamente significativas en número de aciertos en la tarea de recuerdo libre visoespacial inmediato del tercer ensayo (t = 9, 954, g. l = 26, p < . 001) y en el ensayo demorado (t = 3, 063, g. l = 26, p =. 005), donde el grupo de EA puntuó significativamente más bajo que el grupo SC.
Figura 2. Diferencias en tercer ensayo y recuerdo libre demorado de la tarea visoespacial entre los grupos SC y EA
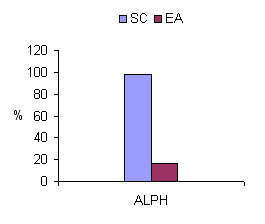
Resultaron diferencias estadísticamente significativas (t = 8, 92, g. l = 26, p =. 009) en el aprendizaje a largo plazo verbal (ALPH) entre el grupo de EA y SC. Los sujetos con EA olvidan mayor cantidad de información verbal que los SC (Figura 3).
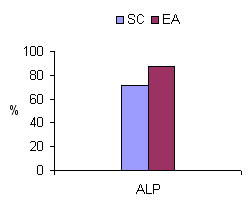
La figura 4 muestra la tasa de aprendizaje a largo plazo de la posición en el tablero (ALP) para los diferentes grupos en la que no existieron diferencias significativas entre el grupo de EA y SC (t = -1, 296, g. l. = 26, p = . 206)
Figura 3. Tasa de aprendizaje de información verbal de los grupos SC y EA
Figura 4. Tasa de aprendizaje de información visoespacial de SC y EA
Discusión
Los resultados demuestran que los sujetos con EA rinden significativamente más bajo en el recuerdo de palabras tanto en el recuerdo inmediato como en el demorado, con una tasa de olvido significativamente mayor a los SC. En consonancia con los resultados, algunos estudios demuestran que existe un déficit en el almacenamiento de información de dígitos y palabras a corto plazo [10], sin embargo el deterioro en las tareas de memoria verbal a largo plazo, especialmente recuerdo libre demorado, asociado a altas tasas de olvido de información han recibido también un fuerte apoyo en la literatura [18] En contra de lo resultados Chapman et al [9] resaltan el valor de las medidas verbales inmediatas, ya que las medidas demoradas de memoria lógica no se encuentran tan deterioradas en pacientes en estadios muy incipientes de la enfermedad. En cierta medida, los análisis estadísticos realizados para medir la tasa de olvido, el tipo de prueba y el deterioro de los sujetos pueden mediar los resultados obtenidos en la memoria a largo plazo [9] De la misma forma los sujetos con EA rinden significativamente más bajo en las tareas de memoria visoespacial inmediata y demorada, aunque la tasa de olvido de información fue similar a los EA y SC. El deterioro en la memoria visoespacial sobre recuerdo de posiciones ha sido contratado en tareas de memoria a corto plazo [11-12]. Por el contrario, Pasquier et al [13] no encuentra tal deterioro en el almacenamiento de secuencia de cubos ya que utilizan baremos normativos sin grupo control y los sujetos tienen una tasa de deterioro menor en comparación al presente estudio. El deterioro en las puntuaciones en el recuerdo de los EA tras un intervalo de tiempo ha sido demostrado [14, 20], sin embargo el principal debate se encuentra en conocer si este deterioro se asocia a una mayor tasa de olvido de información o por el contrario se debe a un problema de adquisición de información. De acuerdo con nuestros resultados, algunos estudios demuestran la existencia de una tasa de olvido normal en el grupo de pacientes con EA frente al grupo control de sujetos sanos control [19] y más que olvido de información, la pérdida se produce esencialmente en el momento inicial tras la presentación de la información [25] Sin embargo, otras investigaciones encuentran una tasa de olvido mayor, en concreto para la medida de recuerdo de dibujo abstracto y no para las medidas de reconocimiento de dibujos y palabras [26]. Así, las diferencias procedimentales respecto a la igualdad en el aprendizaje inicial respecto a los sujetos sanos control, el intervalo de demora más pequeño, la utilización de dibujos abstractos y menor deterioro de los sujetos respecto a nuestro estudio maquen la disparidad en los resultados. Alguna de las limitaciones del estudio puede ser la falta de igualdad en el aprendizaje inicial entre los grupos y su influencia en la tasa de olvido. A pesar de que algunos autores defienden la independencia entre el aprendizaje inicial y el olvido, en muchas ocasiones el intento por igualar el aprendizaje se convierte en un artefacto metodológico. La escasa exposición de estímulos en el grupo control puede inducir a un aumento de la tasa de olvido o por el contrario subestimar la capacidad del EA con tiempos de exposición prolongados. Por otro lado, ya que nuestro objetivo es conocer el valor clínico de la tasa de olvido global en test verbales y no verbales, no hemos considerado diferentes intervalos en la retención de los estímulos para conocer exactamente donde se produce la caída de información y la interacción con los grupos.
A pesar de que la tasa de olvido puede ocurrir como consecuencia de un artefacto debido a la interacción con el instrumento de medida. , parece poco probable debido a que los sujetos se sitúan por encima del efecto suelo, excepto en la medida demorada verbal que ha sido contrastada en la literatura como uno de las medidas más deterioradas en al EA temprana. Incluso en la tasa de olvido visoespacial, donde los SC tienen cierta tendencia a un olvido más rápido que los EA, confronta con el hecho de que el olvido se deba a un error de medida. Finalmente la ampliación de la muestra y la variabilidad de los estímulos en las tareas de memoria nos puedan ayudar a comprender la influencia del material en tareas de recuerdo y reconocimiento.
Bibliografía
1. Villareal DT, Morris JC. The diagnosis of Alzheimer's disease. Alzh Disease Review 1998; 3:142-152.
2. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer´s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer´s Disease. Neurology 1984; 34(7):939-944.
3. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, fourth edition. Washington, D. C. : American Psychiatric Association, 1994.
4. Collie A, Maruff P. The neuropsychology of preclinical Alzheimer's disease and mild cognitive impairment. Neurosci Biobehav Rev 2000; 24(3):365-374.
5. White S, Murphy C. Working memory for nonverbal auditory information in dementia of the Alzheimer type. Arch Clin Neuropsychol 1998; 13(4):339-347.
6. Moye J. Non verbal memory with desing: construct validity and clinical utility. Neuropsychology 1997; 7(4):157-170.
7. Milner B. Interhemispheric differences in the localization of psychological processes in man. Br Med Bull 1971; 27:272-277.
8. Becker JT, Lopez O, Wess, J. Material-specific memory loss in probable Alzheimer's disease. J Neurol Neurosurg Psychiatry 1992; 55(12):1177-1181.
9. Chapman L, Desireé L, White S, Storandt M. Prose recall in dementia. Arch Neurol 1997; 54:1501-1504.
10. Morris RG. Working Memory in Alzheimer-Type Dementia. Neuropsychology 1994; 8(4): 544-554.
11. Della Sala S, Gray C, Baddeley A, Allamano N, Wilson L. Pattern span: a tool for unwelding visuo-spatial memory. Neuropsychologia 1999; 37(10):1189-1199.
12. Grossi D, Becker JT, Smith C, Troyano L. Memory for visoespatial patters in Alzheimer´s disease. Psychol Med 1993; 23:65-70.
13. Pasquier F, Grymonprez L, Lebert F, Van Der Linden M. Memory impairment differs in frontotemporal dementia and Alzheimer's disease. Neurocase 2001; 7(2):161-171.
14. Malec J, Ivnik R, Smith G. Visual spatial learnig test: normative data and futher validation. Psychol Assess 1992; 4(4):433-441.
15. Degenszajn J, Caramelli P, Caixeta L, Nitrini R. . Encoding process in delayed recall impairment and rate of forgetting in Alzheimer's disease. Arq Neuropsiquiatr 2001; 59(2-A):171-174.
16. Bäckman L, Small BJ. Influences of cognitive support on episodic remembering: Tracing the process of loss from normal aging to Alzheimer's disease. Psychol Aging 1998; 13:267-276.
17 Van der Hurk PR, Hodges JR. Episodic and semantic memory in Alzheimer's disease and progressive supranuclear palsy: a comparative study. J Clin Exp Neuropsychol 1995; 17(3):459-471.
18. Welsh K, Butters N, Hughes J, Mohs R, Heyman A. Dectection and staging of dementia in Alzheimer's disease: Use does the neuropsichological measures developed for the Consortium to Establish a Registry for Alzheimer´s Disease. Arch Neurol 1992; 49:448-452.
19. Becker JT, Boller F, Saxton J, McGonigle-Gibson KL. Normal rates of forgetting of verbal and non-verbal material in Alzheimer's disease. Cortex 1987; 23:59-72.
20. Kopelman MD. Non verbal, short term forgetting in the alcoholic korsakoff syndrome and Alzheimer-type dementia. Neuropsychologia 1991; 29:737-747.
21. Sullivan EV, Corkin S, Growdown JH. Verbal and non verbal short term memory in patiens with Alzheimer´s disease and in healthy erderly subjects. Dev Neuropsychol 1986; 2:387-400.
22. Hupper FA, Piercy N. Normal and abnormal forgetting in organic amnesia. Cortex 1979; 15:385-390.
23. Slamecka NJ. On comparing rates of forgetting:Comment on Loftus (1985). J Exp Psychol Learn Mem Cogn 1985; 14:716-727.
24. Loftus GR. On evaluation of interactions. Memory and Cognition 1978; 6:312-319
25. Kopelman MD. Rates of forgetting in Alzheimer type dementia and Korsakoff´s syndrome. Neuropsychologia 1985; 23:623-638.
26. Christensen H, Kopelman M, Stanhope N, Lorentz LO. Rates of forgetting in Alzheimer dementia. Neuropsychologia 1998; 36(6):547-557.
27. Hughes CP, Berg L, Danziger WL, Coben LA, Martin RL. A new clinical scale for the staging of dementia. Br J Psychiatry 1982; 140:566-572.
28. Hachinski VC, Iliff LD, Zinhla E, DuBoulay GH, McAllister V, Marshall L et al. Cerebral Blood flow in demenia. Arch Neurol 1975; 32:632-637.
29. Folstein MF, Folstein SE, McHugh PR. Mini-Mental State: A practical method for grading the state of patients for the clinician. J Psychiatr Res 1975; 12:189-198.
30. Jurica P, Christopher L, Leitten L, Mattis S. Dementia Rating Scale: Professional Manual. Florida: Psychological assesment resource, 2001
31. González Montalvo J. Creación y validación de un test de lectura para el diagnóstico del deterioro mental en el anciano [Tesis Doctoral] Universidad Complutense. Madrid. ; 1991
32. Cacho JL, García García R, Arcaya J, Gay FJ, Guerrero AL, Gómez JC et al. El test del reloj en ancianos sanos. Rev Neurol 1996; 24:1525-1528.
33. Blessed, G. , Tomlinson, B. E. , y Roth, M. (1968). The association between quantitative measures of dementia and of senile change in the cerebral grey matter of elderly subjects. British Journal of Psychiatry, 114, 797-811.
34. Benedict RHB, Schretlen D, Groninger L, Brandt J. Hopkins Verbal Learning Test Revised: Normative data and analysis of inter-form and test-retest reliability. Clin Neuropsychol 1998; 12(1):43-55.
35. Contador I, Fernández Calvo B, Cacho J, Gamazo S, Ramos F. Rendimientos mnésicos en memoria espacial en la EA. neurología 2004; 19(9):624-625. comunicación presentada en LVI reunión Anual de la sociedad española de neurología. Nov 24-27; Barcelona, España.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.
Articulos relacionados
-
Consejos Prácticos para el Cuidador del Paciente con Demencia. JANIER RAMIREZ RODRIGUEZ
Fecha Publicación: 20/09/2025-
Deterioro cognitivo leve: concepto, subtipos y neuropsicología clínica Iván Zebenzui Moreno González et. al
Fecha Publicación: 18/05/2025-
Síntomas psiquiátricos en la Enfermedad de Alzheimer. Sandra Puyal González et. al
Fecha Publicación: 20/05/2024-
Fases de deterioro lingüístico de la enfermedad de Alzheimer. Horus Laffite Cabrera et. al
Fecha Publicación: 11/02/2023-
Habilidades Comunicativas en el Adulto Mayor con Alzheimer Althair Vergara Mckenzie et. al
Fecha Publicación: 11/09/2022-
Apoyo social y resiliencia como predictores de la calidad de vida relacionada con la salud en cuidadores familiares de personas con demencia Pablo Ruisoto Palomera et. al
Fecha Publicación: 20/05/2022
-
-
-
-
-




