El estrés incrementa la quimiotaxis, migración y reclutamiento de mediadores del sistema inmune a los sitios de inflamación. Dicho reclutamiento de linfocitos implica la presencia de quimioquinas (citoquinas quimiotácticas) y de sus respectivos receptores. Trabajos previos muestran una atrofia dendrítica en el área CA3 del hipocampo y una reorganización de las dendritas apicales en neuronas de la corteza prefrontal. Bajo estrés crónico, las quimioquinas ejercen un papel relevante en neuroinflamación, migración celular, supervivencia neuronal y comunicación neurona-glia.
En este trabajo, hemos estudiado la implicación de las quimioquinas CXCR4/SDF1 alfa y CX3CR1/fractalkina, en el bulbo olfatorio de ratas sometidas a neurodegeneración por inmovilización diferencial por estrés crónico de 2, 3 y 6 semanas de duración (6 horas diarias); con objeto de dilucidar si la neuroinflamación producía una regulación diferencial en la expresión de mediadores proinflamatorios (quimioquinas) y apoptóticos (p53 y Bax) en el bulbo olfatorio Nuestros resultados mostraban que tanto CX3CR1 como SDF1 alfa se incrementaban significatívamente bajo 21 días de inmovilización por estrés crónico vs grupos controles no estresados.
Además, se observó una regulación bifásica en la expresión de CXCR4 y fractalkina, ya que ambas se incrementaban bajo 21 días de estrés crónico y se regulaban a la baja bajo 6 semanas de estrés crónico vs grupos controles. Por otro lado, bajo 21 días de estrés crónico, incrementados niveles de SDF1 correlacionaban con la expresión de COX-1 y de p53, respectivamente. En definitiva, el bloqueo de los receptores de quimioquinas podría constituir una nueva diana farmacológica frente a la neurodegeneración inducida en enfermedades neurodegenerativas.
Mecanismos neuroinflamatorios en el bulbo olfatorio de ratas sometidas a diferencial degeneración neural por elevados niveles de corticosterona: incrementados niveles de SDF1 correlacionan con la expresiónde p53.
José Joaquín Merino Martín.
Dpto. psicobiología (UNED)
Resumen
El estrés incrementa la quimiotaxis, migración y reclutamiento de mediadores del sistema inmune a los sitios de inflamación. Dicho reclutamiento de linfocitos implica la presencia de quimioquinas (citoquinas quimiotácticas) y de sus respectivos receptores. Trabajos previos muestran una atrofia dendrítica en el área CA3 del hipocampo y una reorganización de las dendritas apicales en neuronas de la corteza prefrontal. Bajo estrés crónico, las quimioquinas ejercen un papel relevante en neuroinflamación, migración celular, supervivencia neuronal y comunicación neurona-glia. En este trabajo, hemos estudiado la implicación de las quimioquinas CXCR4/SDF1 alfa y CX3CR1/fractalkina, en el bulbo olfatorio de ratas sometidas a neurodegeneración por inmovilización diferencial por estrés crónico de 2, 3 y 6 semanas de duración (6 horas diarias); con objeto de dilucidar si la neuroinflamación producía una regulación diferencial en la expresión de mediadores proinflamatorios (quimioquinas) y apoptóticos (p53 y Bax) en el bulbo olfatorio Nuestros resultados mostraban que tanto CX3CR1 como SDF1 alfa se incrementaban significatívamente bajo 21 días de inmovilización por estrés crónico vs grupos controles no estresados. Además, se observó una regulación bifásica en la expresión de CXCR4 y fractalkina, ya que ambas se incrementaban bajo 21 días de estrés crónico y se regulaban a la baja bajo 6 semanas de estrés crónico vs grupos controles. Por otro lado, bajo 21 días de estrés crónico, incrementados niveles de SDF1 correlacionaban con la expresión de COX-1 y de p53, respectivamente. En definitiva, el bloqueo de los receptores de quimioquinas podría constituir una nueva diana farmacológica frente a la neurodegeneración inducida en enfermedades neurodegenerativas.
Introducción
Desde que se descubrió que las quimioquinas, o citoquinas quimiotácticas (CXCR4 y CCR5) actuaban como correceptores para el virus del SIDA (HIV-1), numerosos trabajos han estudiado la función de dichos receptores en el sistema inmune (Hesselgeeser y cols. , 1998). Sin embargo, se conoce muy poco sobre su funcionalidad en el sistema nervioso. Las quimioquinas constituyen una familia de pequeñas citoquinas acopladas a proteína G (Onuffer y Horuk. , 2002). En este trabajo nos hemos centrado exclusivamente en la quimioquina CXCR4, perteneciente a la familia de las a quimioquinas, cuyo único ligando natural es SDF 1 alfa –Factor Derivado del Estroma-.
Los receptores de quimioquinas ejercen un papel relevante en neuroinflamación, en procesos de comunicación neurona-glia y en la recuperación postraumática del nervio periférico (para revisión consultar Tran, y Miller, 2003).
Antecedentes sobre el papel de CXCR4/SDF1 en neuroprotección versus neuropatología
Varios trabajos otorgan un papel relevante de las quimioquinas en el desarrollo de la formación hipocampal y del cerebelo en el sistema nervioso central, dado que Miller y colegas han puesto de manifiesto en ratones transgénicos del receptor CXCR4 muestran defectos en el desarrollo del hipocampo (Lu y cols. , 2002). Por otro lado, SDF1 alfa induce migración de células granulares del giro dentado (Bagri y cols. , 2003). Especialmente relevante es el hecho de que SDF1 diferencialmente regula la elongación axonal en cultivos neuronales de hipocampo (Pujol y cols. , 2005), procesos que pueden ser alterados en procesos neurodegenerativos. Recientes evidencias, otorgan un papel importante a la quimioquina SDF 1 en reparación tisular en procesos isquémicos, ya que el sistema SDF 1 alpha/CXCR4 induce plasticidad frente al daño tisular inducido (Stumm y cols. , 2002).
El receptor de la quimioquinas CXCR4 fue la primera molécula identificada como co-receptor para la glicoproteína gp120 del virus del HIV-1. Recientemente, se ha demostrado que la infección por HIV produce una serie de alteraciones cognitivas y motoras, similares a las de las enfermedades neurodegenerativas, como consecuencia de la perdida neuronal en diferentes áreas del cerebro (incluyendo el hipocampo). Este síndrome de demencia afecta al 40 % de los niños infectados con HIV tipo I y a un tercio de los adultos infectados con SIDA (Del Valle y Pina-Oviedo. , 2006). Por otra parte, nuevas evidencias apoyan que la infección por HIV y la neuroinflamación asociada a la enfermedad, comprometen la función neural y podría aportar claves asociadas al daño neural asociado a las enfermedades neurodegenerativas. Se sabe que ratas sometidas a estrés crónico muestran una importante atrofia en las dendritas apicales en CA3 (para revisión consultar McEwen. , 2004)
En efecto, la glicoproteína gp120 del HIV induce muerte neuronal a través de la activación de receptores de quimioquinas (Hesselgeeser y cols. , 1998). Varias factores podrían intervenir en la supervivencia neuronal inducida por las quimioquinas, entre los que destacan la coestimulación con otros receptores, las interacciones neurona-glia y variaciones en la actividad neural (Rossi y Zlotnik. , 2000). Sin embargo, es importante reseñar que además de los efectos antiapoptóticos de las quimioquinas, también se han descrito efectos citotóxicos de las mismas, dado que SDF1 alfa es capaz de incrementar la apoptosis (muerte neuronal) en la línea celular HNT (Hesselgeeser y cols. , 1998). Las quimioquinas además de su papel como mediadores inflamatorios, también participan en procesos de proliferación y diferenciación central (para revisión consultar Lazarani et al. , 2003), celular (Bajeto y cols. , 2001). Además, Felszeghy y cols (2004) han puesto de manifiesto que la dexametasona reduce los niveles del receptor CXCR4 y ejerce neuroprotección frente al daño inducido por isquemia (Felszeghy y cols. , 2004).
Por otra parte, niveles incrementados del receptor de quimioquina CCR1 (las quimioquinas también se expresan en células endoteliales) son marcadores tempranos de Alzheimer (Halks-Miller y cols. , 2003). Estas evidencias sugieren un papel dual bien neuroprotector o por el contrario neurodegenerativo, de las quimioquinas en el sistema nervioso central bajo situaciones de daño neural asociadas a procesos de degeneración neural.
Objetivo
En este trabajo, hemos estudiado si existe una regulación diferencial en los niveles proteicos de las quimioquinas CXCR4/SDF1 alfa, en el bulbo olfatorio de ratas sometidas a neurodegeneración por inmovilización diferencial por estrés crónico de 2, 3 y 6 semanas de duración (6 horas diarias). Nuestro objetivo fue determinar si existía una regulación diferencial en la expresión de mediadores proinflamatorios (quimioquinas) y apoptóticos (p53 y Bax) en el bulbo olfatorio de rata. Para ello, se determinó los niveles proteicos de CXCR4/SDF1 por ELISA, así como los niveles de p53 en sinaptosomas y de la proteína Bax (inductor de apoptosis).
Materiales y métodos
Animales
Se utilizaron exclusivamente ratas macho de la cepa Wistar de 3 meses de edad (Ratus novergicus albinus), adquiridas a la empresa Harlan Ibérica y mantenidas en el animalario del Dpto. de psicobiología de la UNED. Las ratas pesaron 180-195 g a su llegada al estabulario, y fueron mantenidas en ciclos de 12 horas de luz y 12 horas de oscuridad (con el comienzo de la fase de luz a las 07:00 horas de la mañana), y a 22 ± 2 ºC de temperatura, con acceso libre a agua y comida.
La alimentación consistió de una dieta sólida de pienso compuesto, mientras que el agua se administró de forma automática por succión de los biberones. Los experimentos se realizaron minimizándose en la medida de lo posible el sufrimiento de los animales según las directrices de la Comunidad Económica Europea, Directiva 86/609/EEC
Procedimientos bioquímicos
Proceso de obtención de sinaptosomas crudos por centrifugación diferencial
Tras homogeneizar el bulbo olfatorio mediante sonicación, se aislaron sinaptosomas de bulbo olfatorio, mediante un proceso de centrifugación diferencial en tampón Krebs de lisis a pH=7, que se almacenaron a -80 ºC para posteriores determinaciones bioquímicas. Por otro lado, los niveles de corticosterone se determinaron mediante Radioinmnoensayo (RIA)
Técnica de ELISA para la determinación de las quimioquinas CXCR4/SDF1
Tras añadir 100 ml de tampón de ¨revestimiento¨ constituido por carbonato /bicarbonato sódico 0, 1 M, pH=9, 6, durante al menos durante 90 minutos a temperatura ambiente, se cargaron 5 o 10 microgramos de antígeno (sinaptosomas de hipocampo y de estriado) en una cámara humidificada a 4 º C durante toda la noche. Tras bloquear la unión inespecífica con BSA (albúmina) en el buffer, se incuba con el anticuerpo primario disuelto en tampón fosfato salino/ Tween 0, 05 %, a pH=7 a la concentración pertinente (ver tabla 1). A continuación, tras incubar con el secundario biotinilado apropiado durante 2 horas a temperatura ambiente en cámara humidificada) y la incubación con estreptavidina-peroxidasa, determinándose la absorbancia de un sustrato colorimétrico a 492 nm de longitud de onda.
Resultados
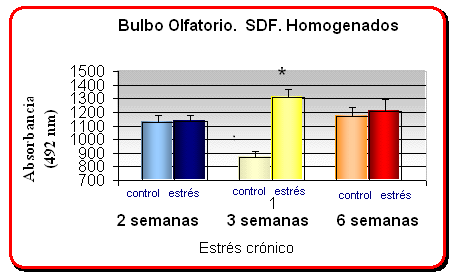
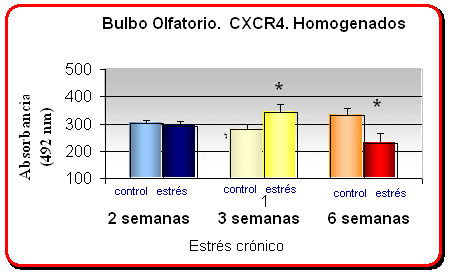
En las gráficas se muestra la media +- el error relativo de los niveles proteicos de las quimioquinas CXCR4/SDF1 medidos por ELISA a 492 nM de longitud de onda
* p<. 05 comparado con el grupo control no estresado en ratas sometidos a un estrés crónico diferencial
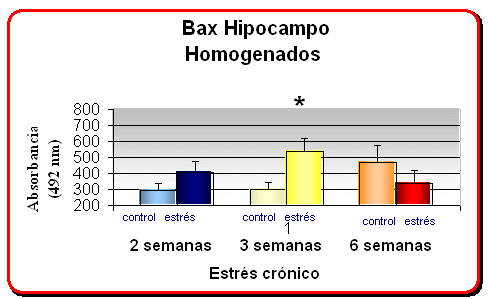
En las gráficas se muestra la media +- el error mostrando un incremento en los niveles proteicos de Bax en ratas sometidas a 21 días de estrés crónico, medido por ELISA a 492 nM de longitud de onda en ratas sometidos a un estrés crónico diferencial
* p<0. 05 comparado con el grupo control no estresado
Conclusiones
· Ratas sometidas a 21 días de estrés crónico (6 horas/dia) muestran un aumento en los niveles proteicos de SDF1 en el bulbo olfatorio en comparación a los mostrados por ratas controles no estresadas.
· Existe una modulación bifásica en la expresión del receptor CXCR4 en el bulbo olfatorio de ratas sometidas a estrés crónico diferencial, de forma que ratas crónicamente estresadas por inmovilización durante 21 días (6 horas/dia) muestran un incremento significativo en los niveles proteicos de CXCR4, mientras que se observó un decremento significativo en los niveles de CXCR4 en ratas sometidas a 6 semanas de estrés crónico, en comparación a los mostrados por ratas controles no estresadas.
· Dado que se observó una alta correlación entre los niveles de SDF1 y de i-NOS en ratas sometidas a 21 días de estrés crónico, sugerimos que niveles incrementados de SDF1 en el bulbo olfatorio de ratas crónicamente estresadas durante 21 días, podría ser una señal inductora de degeneración neural. Especialmente relevante, es el hecho de que además, los animales sometidos a 21 días de estrés crónico incrementen significativamente los niveles de la proteína Bax (inductor de apoptosis o muerte celular programada).
Bibliografía
· Bagri, A. , Gurney, T. , He, X. , Zou, Y. R. , Littman D. R, Tessier-Lavigne, M. y Pleasure S. J. (2002). The chemokine SDF1 regulates migration of dentate granule cells. Development. 129(18): 4249-60
· Bajetto, A. , Bonavia, R. , Barbero, S y Schettini, G. (2002) Characterization of chemokines. and their receptors in the central nervous system: physiopathological implications. J. Neurochem. ; 82(6):1311-29.
· Del Valle L, Pina-Oviedo S (2006). HIV disorders of the brain: pathology and pathogenesis. Front Biosci. 1 (11):718-32.
· Felszeghy, K. , Banisadr, G. , Rostene, W. , Nyakas, C y Haour, F. (2004). Dexamethasone downregulates chemokine receptor CXCR4 and exerts neuroprotection against hypoxia/ischemia-induced brain injury in neonatal
rats. Neuroimmunomodulation. 11(6):404-13.
· Halks-Miller, M. , Schroeder, M. L. , Haroutunian, V. , Moenning, U. , Rossi, M. , Achim, C. , Purohit , D. , Mahmoudi, M y Horuk, R. (2003). CCR1 is an early and specific marker of Alzheimer's disease. Ann. Neurol. 54(5):638-46.
· Harrison, J. K, Jiang, Y. , Chen, S. , Xia, Y. , Maciejewski, D. , McNamara, R. K, Streit, W. J, Salafranca, M. N. , Adhikari, S. , Thompson, D. A. , Botti, P. , Bacon, K. B y Feng, L (1998). Role for neuronally derived fractalkine in mediating interactions between neurons and CX3CR1-expressing microglia. PNAS 1; 95(18):10896-901
· Hesselgesser, J. , Taub, D. , Baskar, P. , Greenberg, M. , Hoxie, J. , Kolson, D. L y Horuk, R. (1998) Neuronal apoptosis induced by HIV-1 gp120 and the chemokine SDF-1 alpha is mediated by the chemokine receptor CXCR4. Curr Biol. 7; 8(10):595-8.
· Lazarini, F. , Tham, T. N. , Casanova, P. , Arenzana-Seisdedos, F y Dubois-Dalcq, M. (2003). Role of the alfa-chemokine stromal cell-derived factor (SDF-1) in the developing and mature central nervous system. glia. 15; 42(2):139-48.
· Lu, M. , Grove, E. A y Miller, R. J. (2002) Abnormal development of the hippocampal dentate gyrus in mice lacking the CXCR4 chemokine receptor. PNAS 14; 99(10):7090-5.
· McEwen BS. Protection and damage from acute and chronic stress: allostasis and allostatic overload and relevance to the pathophysiology of psychiatric disorders. (2004) Ann N Y Acad Sci. Dec; 1032:1-7.
· Onuffer, J. J y Horuk, R. (2002) Chemokines, chemokine receptors and small-molecule antagonists: recent developments. Trends Pharmacol Sci. ; 23(10):459-67.
· Pujol, F. , Kitabgi, P y Boudin, H. (2005) The chemokine SDF-1 differentially regulates axonal elongation and branching in hippocampal neurons. J Cell Sci. 1; 118(Pt 5):1071-80
· Rossi, D y Zlotnik, A. (2000). The biology of chemokines and their receptors. Annu Rev Immunol. ; 18:217-42.
· Stumm, R. K. , Rummel, J. , Junker, V. , Culmsee, C. , Pfeiffer, M. , Krieglstein, J. , Hollt, V y Schulz, S. (2002). A dual role for the SDF-1/CXCR4 chemokine receptor system in adult brain: isoform-selective regulation of SDF-1 expression modulates CXCR4-dependent neuronal plasticity and cerebral leukocyte recruitment after focal ischemia. J Neurosci. 15; 22(14):5865-78. .
· Tran, P. B y Miller, R. J. (2003). Chemokine receptors: signposts to brain development and disease. Nat . Rev. Neurosci. ; 4(6):444-55.
· Zhang, K. , McQuibban, G. A. , Silva, C. , Butler, G. S. , Johnston, J. B. , Holden, J. , Clark-Lewis, I. , Overall, C. M y Power C. (2003). HIV-induced metalloproteinase processing of the chemokine stromal cell derived factor-1 causes neurodegeneration. Nat. Neurosci. 6(10):1064-71. Epub 2003 Sep 21.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.