Repositorio de Artículos | Congreso Virtual Internacional de Psiquiatría, Psicología y Salud Mental (Interpsiquis) | VII Edición | 2006
Estudio sobre la frecuencia y características de deterioro cognitivo ligero amnésico en una población de un centro de mayores de Madrid
Autor/autores: Ana Isabel Reinoso García
RESUMEN
OBJETIVOS: 1. Estudiar la frecuencia de DCLAmnésico en una población de Centros de Mayores de Madrid 2. Estudiar las características de la población con DCLAmnésico diferenciándola de sujetos normales.
METODOLOGÍA: 120 usuarios pertenecientes a dos Centros de Mayores Edad media 72, 54 años (SD = 6, 20); 20, 7 % varones. Evaluación: Lista de palabras Wechsler, Lista de palabras UMAM, Mini Examen Cognoscitivo (MEC), escala Geriátrica de depresión (GDS), Test Conductual de memoria Rivermead (RBMT), Lista de pares asociados, Perfil de Salud Nottingham, cuestionario de Fallos de memoria de la Vida Diaria (MFE), Preguntas de Quejas. Captación de la población: Información general en Centros de Mayores. Criterios de DCL Amnésico: Petersen y cols. (2001).
RESULTADOS: Quejas de memoria: 61, 2 % ; memoria normal: 30, 5 %; deterioro cognitivo (criterio: Wechsler 1½ DT por debajo de la media normal): 23, 6- 27, 3 %; MEC< de 24 : 5 %. deterioro Cognitivo Ligero tipo Amnésico: 18, 6 ? 22, 3 %. Diferencias Normales ? deterioro Cognitivo Variables Normales DetCognitivo Signif Edad 71, 3 (6, 0) 77 (5, 4) 0, 000 AñosEduc. 9, 4 (3, 3) 7, 4 (3, 9) 0, 009 Wechsler Total 29, 6 (5, 9) 17, 0 (2, 5) 0, 000 Wechsler Demo 7, 4 (2, 2) 3, 3 (1, 5) 0, 000 RBMT Global 8, 2 (2, 3) 4, 9 (3, 2) 0, 000 MEC 31, 4 (2, 5) 27, 4 (5, 0) 0, 000 GDSDepres9, 8 (6, 4) 11, 7 (6, 9) n. s. Preg. Quejas 1, 68 (0, 9) 1, 88 (0, 9) n. s. MFE Quejas 13, 8 (13, 9) 17, 9 (10, 3) 0, 05
CONCLUSIONES: La frecuencia de DCL Amnésico es de 18, 6% o 22, 3 % según se estudie con memoria reciente o demorada Hay diferencias significativas entre sujetos normales y los que tienen deterioro cognitivo en las variables que miden aspectos cognitivos, pero no en otras como depresión, actividad social, etc. Las variables que más discriminan entre normales y deterioro cognitivo son todas las de memoria. Las quejas de memoria son factor de riesgo, pero su poder discriminativo es bajo.
Palabras clave: deterioro cognitivo
Tipo de trabajo: Conferencia
Área temática: Neurocognitivos, Trastornos neurocognitivos .
Estudio sobre la frecuencia y características de deterioro Cognitivo Ligero Amnésico en una población de un centro de mayores de Madrid
Montejo Carrasco, Pedro; Andrés Montes, Mª Emiliana de; Reinoso García, Ana Isabel; Montenegro Peña, Mercedes; Montes Cortaberría, Adolfo.
Centro de prevención de deterioro Cognitivo.
Instituto de Salud Pública. Madrid Salud. Ayuntamiento de Madrid.
Resumen
OBJETIVOS: 1. Estudiar la frecuencia de DCLAmnésico en una población de Centros de Mayores de Madrid 2. Estudiar las características de la población con DCLAmnésico diferenciándola de sujetos normales.
METODOLOGÍA: 120 usuarios pertenecientes a dos Centros de Mayores Edad media 72, 54 años (SD = 6, 20); 20, 7 % varones. Evaluación: Lista de palabras Wechsler, Lista de palabras UMAM, Mini Examen Cognoscitivo (MEC), escala Geriátrica de depresión (GDS), Test Conductual de memoria Rivermead (RBMT), Lista de pares asociados, Perfil de Salud Nottingham, cuestionario de Fallos de memoria de la Vida Diaria (MFE), Preguntas de Quejas. Captación de la población: Información general en Centros de Mayores. Criterios de DCL Amnésico: Petersen y cols. (2001).
RESULTADOS: Quejas de memoria: 61, 2 % ; memoria normal: 30, 5 %; deterioro cognitivo (criterio: Wechsler 1½ DT por debajo de la media normal): 23, 6- 27, 3 %; MEC< de 24 : 5 %. deterioro Cognitivo Ligero tipo Amnésico: 18, 6 – 22, 3 %. Diferencias Normales – deterioro Cognitivo Variables Normales DetCognitivo Signif Edad 71, 3 (6, 0) 77 (5, 4) 0, 000 AñosEduc. 9, 4 (3, 3) 7, 4 (3, 9) 0, 009 Wechsler Total 29, 6 (5, 9) 17, 0 (2, 5) 0, 000 Wechsler Demo 7, 4 (2, 2) 3, 3 (1, 5) 0, 000 RBMT Global 8, 2 (2, 3) 4, 9 (3, 2) 0, 000 MEC 31, 4 (2, 5) 27, 4 (5, 0) 0, 000 GDSDepres9, 8 (6, 4) 11, 7 (6, 9) n. s. Preg. Quejas 1, 68 (0, 9) 1, 88 (0, 9) n. s. MFE Quejas 13, 8 (13, 9) 17, 9 (10, 3) 0, 05
CONCLUSIONES: La frecuencia de DCL Amnésico es de 18, 6% o 22, 3 % según se estudie con memoria reciente o demorada Hay diferencias significativas entre sujetos normales y los que tienen deterioro cognitivo en las variables que miden aspectos cognitivos, pero no en otras como depresión, actividad social, etc. Las variables que más discriminan entre normales y deterioro cognitivo son todas las de memoria. Las quejas de memoria son factor de riesgo, pero su poder discriminativo es bajo.
Introducción
Las alteraciones cognitivas que actualmente se consideran en los mayores son la alteración de la memoria por la edad, el deterioro cognitivo leve y la demencia en sus distintas fases de gravedad. Generalmente, la función más alterada es la memoria.
Deterioro cognitivo es la disminución mantenida del rendimiento de las funciones intelectuales o cognitivas desde un nivel previo más elevado. Las causas son múltiples: demencia, depresión, alteración por la edad, accidentes o procesos cerebro-vasculares, alcoholismo, daño cerebral traumático, cirugía del cerebro, etc. (1)
El DCL es un estado entre el envejecimiento normal y la demencia leve, que agrupa a pacientes con un declinar cognoscitivo cuya cuantía sobrepasa el envejecimiento normal, aunque no es suficientemente severo para diagnosticar una demencia.
La prevalencia del trastorno es elevada, aunque diferentes estudios muestran importantes discrepancias debido al entorno en el que se han realizado, la metodología y los criterios diagnósticos empleados. Esta prevalencia oscila entre el 17 y el 34 %(2). En el estudio de Pittsburg, la prevalencia va desde el 20, 7 % hasta el 39 % según la edad(3). La tasa de conversión anual de pacientes con DCL a Alzheimer se encuentra entre 6-25%, en función de la población estudio. La tasa más admitida es del 15 % por año de progresión a demencia.
La incidencia de DCL en poblaciones mayores de 65 años es de 12 a 15 por 1000 habitantes al año y, al igual que la demencia, el DCL aumenta con la edad. La incidencia aumenta en grupos mayores de 75 años a 54/1000 habitantes al año (4).
Se han realizado numerosos estudios sobre los factores predictores de conversión a demencia: Predictores neuropsicológicos(5), (6)(7), genéticos(8)(9), de neuroimagen(10) (11), bioquímicos(12) y otros.
El DCL se puede clasificar según la función cognitiva alterada: DCL amnésico (suele evolucionar a enfermedad de Alzheimer), DCL con otras funciones cognitivas alteradas además de la memoria (puede evolucionar a Alzheimer, demencia Vascular u otras demencias) y DCL sin alteración de la memoria (puede evolucionar a otros tipos de demencias: demencia Frontotemporal, demencia por cuerpos de lewy, . . . )(13). Otro modo de clasificarlo es teniendo en cuenta su evolución y, por lo tanto, se habla de deterioro cognitivo vascular, mixto, frontotemporal, etc.
Respecto a los criterios de diagnóstico los más utilizados son los de Petersen y cols (14), aunque algunos autores plantean otros(15). En España, la Sociedad Española de neurología (SEN) plantea unos criterios parcialmente diferentes de los de Petersen (16). Con un objetivo diferente, tenemos los de la GDS de Reisberg y cols. (17) y los de la Clinical Dementia Rating Scale (CDR) (18) cuyos estadíos 3 y 0, 5 respectivamente, se solapan con el DCL. En general para el DCL la mayoría de autores están de acuerdo en que: Es una alteración que afecta sobre todo a la memoria, aunque pueden alterarse otras funciones cognitivas (funciones ejecutivas, atención / concentración, lenguaje, funciones visuoespaciales, . . . ); se conserva la capacidad funcional para las actividades de la vida diaria; con frecuencia esta alteración evoluciona a demencia.
Estos acuerdos y los criterios que se utilizan no resuelven uno de los problemas que se plantean cuando se hacen estudios sobre este cuadro: qué caso es DCL. Las alteraciones de las funciones cognitivas, entre ellas la memoria, en los sujetos con envejecimiento normal, con DCL o con demencia en la realidad son un continuum (de menos a más), pero hay que poner límites entre un estado y otro, y estos límites en el momento actual son arbitrarios aunque sean consensuados. Por otra parte, si hablamos de alteración de la memoria, ¿ a qué tipo de memoria nos referimos?. Puede ser memoria reciente, demorada, visual o visuoespacial, auditiva, episódica, etc. Algunos de estos tipos de memoria pueden estar alterados, mientras que otros no. Si , por otra parte, indicamos, como la mayoría de autores que nos referimos a memoria episódica auditiva demorada, nos planteamos el modo de medirla: textos, listas de palabras, pares asociados, etc. en cada una de estas pruebas las alteraciones pueden ser diferentes.
Si se trata de cada individuo concreto el problema se puede complicar aún más.
La detección precoz del DCL y la identificación de los individuos con mayor riesgo de desarrollar demencia es actualmente un reto de máximo interés clínico, sanitario y social. Esta detección precoz permitiría desarrollar protocolos de seguimiento para adoptar medidas terapéuticas de diverso tipo con el objetivo de prevenir o, al menos retrasar, el inicio de la demencia.
Nuestro trabajo pretende sobre todo contribuir con datos a la reflexión sobre los problemas diagnósticos del DCL.
Objetivos
1- Estudiar la frecuencia de DCL tipo Amnésico en una población de personas mayores usuaria de los Centros de Servicios Sociales de Madrid.
2-Estudiar las características de la población con DCL tipo Amnésico diferenciándola de sujetos normales.
3- Estudiar qué pruebas discriminan entre sujetos normales y sujetos con deterioro cognitivo.
Material y método
POBLACIÓN
Se han estudiado 120 personas (edad media 72, 54 DT= 6, 20). Los sujetos son los que acuden habitualmente a dos Centros de Mayores de Servicios Sociales del Distrito de Retiro de la ciudad de Madrid. La captación se realizó mediante información general aparecida en los tablones donde se exponen las actividades habituales del Centro y se les ha ofertado realizar una evaluación de memoria.
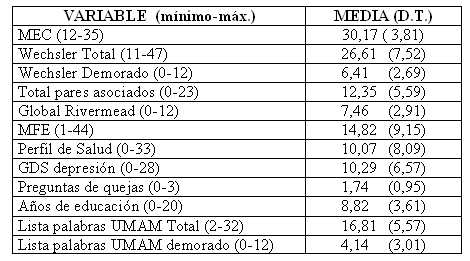
Las características de la población se describen en la tabla 1.
Tabla 1. Características de la población del estudio
EVALUACIÓN DE USUARIOS
Se realiza una entrevista clínica por cuatro profesionales, dos médicos y dos psicólogos. Entre las pruebas utilizadas en la evaluación están: Mini Examen Cognoscitivo (MEC) de 35 items, adaptación española de Lobo y cols(19) (20) del Mini-Mental State Examination (MMSE) de Folstein y cols (21) (punto de corte: 23/24). escala Geriátrica de depresión (GDS) de Yesavage y cols(22), instrumento adaptado y validado para población geriátrica española(23) (punto de corte 17/18).
Para la evaluación objetiva de memoria se emplean:
-Test Conductual de memoria Rivermead (RBMT) de Wilson y cols. (24), con un rango de puntuación Global de 0-12 puntos, clasifica el rendimiento de memoria como Normal, memoria Débil, trastorno Moderado y trastorno Severo.
-Subtest de Lista de palabras de WMS-III (25), lista de doce nombres concretos que se realiza con cuatro ensayos de aprendizaje, un recuerdo demorado y una lista de reconocimiento. El criterio para trastorno de memoria en DCL se obtiene aplicando la puntuación total de esta prueba (con alguna referencia a la puntuación demorada de la misma).
-Lista de palabras UMAM (Unidad de memoria Ayuntamiento de Madrid), que consta de 12 nombres concretos que corresponden a tres categorías semánticas y se realiza en tres ensayos de aprendizaje, recuerdo demorado y reconocimiento (se utiliza exclusivamente como chequeo de la propia prueba)
-Lista de aprendizaje de Pares Asociados (26) elaborada por la Unidad de memoria, que consta de ocho pares de palabras y se realiza en tres ensayos de aprendizaje y un recuerdo demorado.
La evaluación subjetiva de memoria se realiza con:
-Preguntas de Quejas, elaboradas a partir del SCAN (27) (Entrevista Clínica Neuropsiquiátrica) y del CAMDEX (Entrevista clínica estructurada de la Universidad de Cambridge) (28); son tres preguntas sobre quejas de memoria, utilizadas como cribaje. En este trabajo consideramos que hay quejas de memoria cuando contesta positivo al menos a una de las tres preguntas.
-Cuestionario de Fallos de memoria de la Vida Diaria (MFE) de Sunderland y cols (29). que consta de 28 ítems que hacen referencia a olvidos cotidianos.
La evaluación se completa con el Índice de Lawton (30) que evalúa actividades instrumentales de la vida diaria. Esta evaluación funcional se precisa para incluir a los sujetos dentro de los criterios de DCL.
Para evaluar la calidad de vida se emplea el Perfil de Salud de Nottingham (31), adaptado y validado para población española (32), que mide la autopercepción del estado de salud en seis dimensiones.
Para el análisis estadístico se ha utilizado el Programa SPSS. Se ha empleada la T de Student para la ccomparación de medias para grupos independientes y el análisis discriminante con introducción de las variables independientes juntas.
Resultados
En la tabla 2 se encuentran las medias y DT de las pruebas empleadas
Tabla 2. Medias y DT. de las pruebas empleadas en la evaluación
Los resultados se van a presentar siguiendo el orden de los criterios de Petersen presentando datos para cada uno de ellos.
1. Quejas de memoria. Refieren que no tienen problemas de memoria el 11, 6 %; el resto, 88, 4 % tienen quejas de memoria; de estos, responden que sí a una pregunta, el 27, 2 %; a dos preguntas: el 37, 2 % y sí a las tres preguntas de quejas, el 24 %.
2. trastorno de Memoria: Los niveles de memoria según la puntuación Global del Rbmt se presentan en la tabla 3.
Tabla 3. Niveles de memoria de la población del estudio
La media del Wechsler de los sujetos que tienen memoria Normales es: 30, 67 (D. T. 6, 49). Menos 1 ½ DT = 20, 9.
Los sujetos que tienen menos de 20, 9 en la prueba de memoria del Wechsler Puntuación Total son el 23, 6 %.
2. Función cognitiva general normal: Hay un 5 % de sujetos que tienen MEC menor de 24. Todos ellos tienen alteraciones, además de en la memoria, en atención- concentración, abstracción, órdenes, escritura y dibujo.
3. Sin alteraciones funcionales en las actividades de la vida diaria: Hay 2 personas (mujeres) que puntúan menos de 8 en el Lawton (el 1, 6 %) , su MEC es de 12 y 18 (están ya incluidas en el 5 % del apartado anterior).
4. Alteración cognitiva o ausencia de demencia. Todos los usuarios excepto los dos del apartado 4.
El análisis de los resultados define que el 23, 6 % de los sujetos tiene deterioro Cognitivo, de ellos 18, 6% corresponde a deterioro Cognitivo Leve Amnésico y 5% a deterioro Cognitivo Probable demencia.
Si en vez de utilizar la puntuación total de la lista de palabras del Wechsler se utiliza otra prueba de memoria (también episódica) los resultados son diferentes: con la puntuación de la presentación demorada del Wechsler: tienen deterioro cognitivo el 27, 3 %; con la lista UMAM total, el 21 %.
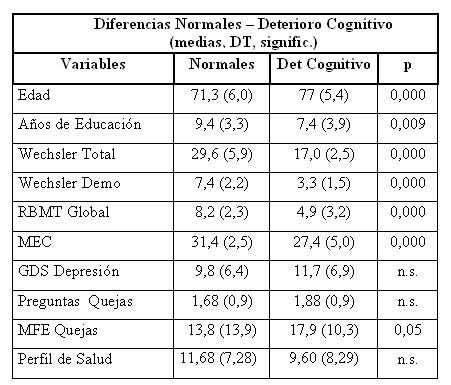
Las diferencias entre los sujetos normales y los que tienen deterioro Cognitivo se presentan en la tabla 4.
Tabla 4. Diferencias entre sujetos con deterioro cognitivo y normales
Con el fin de ampliar el estudio de las características de los dos grupos (sujetos normales y con deterioro cognitivo) y ver en qué medida otras variables intervienen en esta diferenciación realizamos análisis discriminante.
Tabla 5. análisis discriminante entre los grupos con deterioro cognitivo y normales
La función discriminante clasifica a los sujetos del modo como se indica en la tabla 6:
Tabla 6 clasificación de normales / deterioro cognitivo
La gráfica 1 representa la función discriminante para ambos grupos.
Gráfico 1. Representación de normales y DCL según la función discriminante
Conclusiones
· La frecuencia del DCL Amnésico en esta población es de 18, 6% teniendo en cuenta todos los criterios de Petersen. En varios de ellos se deberían concretar más lo que significa cumplir el criterio, por ejemplo, qué significa tener quejas de memoria, cómo cumplir el criterio objetivo de trastorno de memoria, etc. La frecuencia encontrada está entre las que presentan otros autores. Este porcentaje va ligado a la prueba criterio de memoria. Las otras pruebas que hemos utilizado han dado unos porcentajes algo diferentes a pesar de que todas son de tipo auditivo y memoria episódica. Este fenómeno del desacuerdo sucede también por ejemplo en el diagnóstico de la demencia ( ver, entre otros, en el Canadian Study of Health and Aging) (33). La solución puede venir por un total acuerdo entre investigadores con respecto a pruebas concretas a utilizar (puntuación total, demorada…). Además, se debe tener siempre presente que el factor neuropsicológico es uno de los criterios a cumplir y no puede sólo por sí mismo solucionar el problema.
· Hay diferencias significativas entre los sujetos normales y los que tienen deterioro cognitivo, en todas las variables que miden aspectos cognitivos, pero no en otras como depresión, Perfil de Salud, etc. Es razonable que esto suceda para el DCL de tipo amnésico, pero no tiene que ser así para todos los demás tipos de DCL. Por definición, en el DCL la clave es lo cognitivo, es probable que en poco tiempo se estudien mejor DCL que comiencen por depresión o quizá por otra sintomatología (véase que hay un porcentaje importante de demencias que comienzan por síntomas afectivos).
· Las variables que más discriminan entre el grupo de normales y el de deterioro cognitivo son todas las de memoria lo cual es coherente con el criterio de definición. El porcentaje de bien clasificados alcanza el 91 %. Los bien clasificados son el 95 % de los sujetos normales, pero el 80 % de los que tienen deterioro cognitivo; hay un 20 % de sujetos con deterioro que son clasificados como normales teniendo en cuenta sólo el criterio de memoria medido por el Wechsler.
· Una de las pruebas que habitualmente se emplean en un protocolo de DCL es el MEC o MMSE. En nuestro estudio la media del MEC para DCL (27, 4) está muy por encima del punto de corte para deterioro Cognitivo / demencia (23/24), por lo cual nos planteamos si sería conveniente buscar puntos de corte específicos para DCL en el MEC y/o en otras pruebas de screening. En la función discriminante, el hecho de que el coeficiente tipificado del MEC sea más alto que el del RBMT probablemente tenga que ver con el hecho de la multicolinealidad entre el RBMT y las demás variables de memoria.
· En las quejas de memoria medidas con las “Preguntas de Quejas” no hay diferencias significativas entre normales y sujetos con deterioro cognitivo. Estas preguntas de screening son algo de tipo muy general y van muy ligadas a aspectos afectivos y de salud general (véase nuestra comunicación sobre quejas de memoria). En la valoración de quejas con el MFE sí hay mayores diferencias y son significativas. Las quejas de memoria son ya consideradas como factor de riesgo (34) y por esto deben ser un elemento de inclusión en los “screening”, pero su poder discriminativo es bajo
Bibliografía
1 Ebly, et al. Cognitive Impairment in the non demented elderly. Results from the Canadian Study of Health and Aging. Archives of Neurology 1995; 52: 612-619.
2 Morris, et al. Mild Cognitive Impairment represents early stage Alzheimers-Disease. Archives of Neurology 2001; 58: 397-405.
3 López, OL. , Kuller, LH. , Fitzpatrick, A. , et al. Evaluations of dementia in the Cardiovascular Health Cognition Study. Neuroepidemiology 2003; 22: 1-12.
4 Ganguli, M. , Dodge, H. , Chen, P. , Belle, S. , Dekosky, ST. Ten-year incidence of dementia in a rural elderly US community population. Neurology 2000; 54: 1109-16.
5 Unverzagt, F. , Gao, S. , Baieyewu, O. , Ogunniyi, A. , et al. Prevalence of cognitive impairment: data from the Indianapolis Study of Health and Aging. Neurology 2001; 57:1655-62.
6 Estevez Gónzalez, A. , Kulisevsky, J. , Boltes, A. , Otermin, P. , García-Sánchez, C. Rey verbal learning test is a useful tool for differential diagnosis in the preclinical phase of Alzheimer’s disease: comparison with mild cognitive impairment and normal aging. Int J Geriatr Psychiatry 2003; 18 (11): 1021-8.
7 Bozoki, A. , Giordani, B. , Heidebrink, J. , Berent, S. , et al. Mild Cognitive impairment predict dementia in non demented elderly patients with memory loss. Arch Neurol. 2001; 58: 411-16.
8 Bartrés-Faz, D. , Junque, C. , López, A. , Valveny, N. , et al. Apo E influences declarative and procedural learning in age-associated memory impairment. Neuroreport 1999; 10: 2923-79.
9 Dik, MG. , Jonker, C. , Bouter, LM. , Geerlings, M. , et al. ApoE- E4 is associated with memory decline in cognitive impaired elderly. Neurology 2000; 54: 1492-7.
10 Daly, E. , Zaitchik, D. , Copeland, M. , Scamahmann, J. , et al. Predicting Conversion to Alzheimer Disease using Standardized Clinical Information. Arch Neurol. 2000; 57: 675-80.
11 Jack, C. , Petersen, R. , Xu, Y. , O´Brien, P. , et al. Rates of Hippocampal atrophy correlate with change in clinical status in aging and AD. Neurology 2000; 55: 484-90.
12 Riemenschneider, M. , Lautenschlager, N. , Wagenpfeil, S. , Diehl, J. , et al. Cerebrospinal fluid Tau and B-amyloid 42 proteins identify Alzheimer disease in subjects with mild cognitive impairment. Arch Neurol. 2002; 59: 1729-34.
13 Peterson, RC. , Dolly, R. , Kurtz, A. , Mohs, RC. , Morris, JC. , Rabins, PV. , Ritchie, K. , Rossor, M. , Thal, L. , Winblad, B. Current Concepts in Mild Cognitive Impairment. Arch Neurol 2001; 58:1985-1992.
14 Petersen, R. , Smith, G. , Waring, S. , Ivnik, R. , et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol. 1999; 56: 303-8.
15 Zaudig, M. A new systematic method of measurement and diagnosis of Mild Cognitive Impairment and dementia according to ICD-10 and DSM III-R criteria. Int Psychogeriatr. 1992; 4: 203-219.
16 Robles, A. , Del Ser, T. , Alom, J. , Casanova, P. , y cols. Propuesta de criterios para el diagnóstico clínico del deterioro Cognitivo Ligero, la demencia y la enfermedad de Alzheimer. neurología, 2002; 17 (1) 17-32.
17 Morris, JC. The Clicical Dementia rating (CDR): current version and scoring rules. Neurology 1993; 43: 2412-14.
18 Reisberg, B. , Ferris, SH. , de León, MJ. , Crook, T. The Global Deterioration Scale for the Assessment of Primary Degenerative Dementia. American J. of Psychiatry 1982; 139: 1136-39
19 Lobo, A. Screening de trastornos psíquicos en la práctica médica. Zaragoza: Universidad de Zaragoza. Secretariado de publicaciones; 1987.
20 Lobo, A. , Gómez Burgada, F. , Escolar, V. , Seva Díaz, A. El mini-examen cognoscitivo en pacientes geriátricos. Folia Neuropsiquiátrica, 1979; XIV: 244-251.
21 Folstein, MF. , Folstein, SE. , McHugh, PR. Mini Mental State: A practice method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research 1975; 12:189-198.
22 Yesavage J. Development and Validation of a GDS. Journal of Psychiatry 1983; 17 (1):37-49.
23 Ramos, JA. , Montejo, ML. , Lafuente, R. , Ponce de León, C. , Moreno, A. Validación de la escala-criba geriátrica para la depresión. Actas luso-españolas de neurología, psiquiatría y Ciencias afines 1991; 3: 174-77.
24 Wilson, BA. , Cockburn, J. , Baddeley, A. The Rivermead Behavioural Memory Test, Bury St. Edmunds: Thames Valley Test Company; 1985.
25 Wechsler, D. WMS-III. escala de memoria de Wechsler III. Madrid: TEA Ediciones; 2004.
26 Montejo, P. , Montenegro, M. , Reinoso, AI. , De Andrés, ME. , Claver, MD. Programa de memoria. Método UMAM. 2ª edición. Madrid; Díaz de Santos, 2001.
27 Vázquez Barquero, JL. et al. SCAN: Cuestionarios para la evaluación clínica en neuropsiquiatría. OMS. Madrid; Meditor, 1993.
28 Roth, M. , Tym, E. , Mountjoy, CQ. , Huppert, FA. , Hendrie, H. , Verma, S. , Goddard, R. CAMDEX, a standardized instrument for the diagnosis of mental disorders in the elderly with the special reference to the early detection of dementia. British Journal of Psychiatry, 1986; 149: 698-709.
29 Sunderland, A. , Harris, JE. , Gleave, J. Memory Failures Everyday Life Following Severe Head Injury. Journal of Clinical Neurology 1984; 6:127-142.
30 Lawton, MP. , Brody, EM. Assessment of older people: self-maintaining and instrumental activities of daily living. Gerontologist 1969; 9:179-186.
31 Hunt, SM. , Mc Ewen, I. The development of a subjective indicator. Soc Health Illnes 1980; 2:231-246.
32 Alonso, J. , Antó, JM. , Moreno, C. Spanish version of the Nottingham Health Profile: translation and preliminary validity. Am J Public Health 1990; 80:704-708.
33 Erkinjuntti T. , Østbye, T. , Steenhuis, R. , Hachinski, V. The Effect of Different Diagnostic Criteria on the Prevalence of Dementia. The New England Journal of Medicine, 1997; 337:1667-1674.
34 O’Brien JT, Beats B, Hill, K y cols. Do subjective memory complaints precede dementia? A three years follow-up of patients with supposed “Benign senescent forgetfulness”. International Journal of Geriatric Psychiatry. 1992; 7: 481- 486
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.





Articulos relacionados
-
Deterioro cognitivo leve: concepto, subtipos y neuropsicología clínica Iván Zebenzui Moreno González et. al
Fecha Publicación: 18/05/2025-
Envejecer siendo joven. El impacto de las drogas. Aida Hamdani Mañas et. al
Fecha Publicación: 18/05/2025-
Deterioro cognitivo y salud mental en personas con esclerosis múltiple Diana Navas Guijarro et. al
Fecha Publicación: 20/05/2024-
Depresión en el paciente anciano Gloria Pérez Guerrero et. al
Fecha Publicación: 20/05/2024-
LA EVALUACIÓN PSICOLÓGICA EN ADULTOS MAYORES Y PACIENTES CON DETERIORO COGNITIVO. Compilación de artículos de la práctica clínica Sandra Ochoa Durán
Fecha Publicación: 17/09/2021-
Evolución de la Utilidad Diagnóstica en Demencias del Test del Reloj en Mujeres Mayores Institucionalizadas Vanessa Sanz López et. al
Fecha Publicación: 08/01/2021
-
-
-
-
-



