Fundamentos. La población adicta a drogas por vía parenteral tiene una prevalencia de infección por el virus de la inmunodefieciencia humana del 65%. La metadona es un mórfico sintético, utilizado en el tratamiento de desintoxicación y mantenimiento en adictos a la heroína. No se conocen pautas de adaptación de la dosis de metadona en función del uso de antiretrovirales, aunque se han descrito interacciones individuales entre la metadona y estos fármacos. Caso clínico. Paciente en tratamiento de mantenimiento con metadona con una dosis estabilizada y mantenida de 60 mg / día en el año previo. Inicia tratamiento con Zerit (estavudina) 1/12 h. Crixivan (indinavir) 2/12h, Norvir (ritonavir) 1/12h y Viramune (nevirapina) 1/12h.
El cuarto día a partir del inicio de la medicación antirretroviral el paciente refiere síntomas compatibles con un síndrome de abstinencia a metadona: ansiedad, insomnio, diarrea, piloerección, vómitos y agitación. Se aumenta progresivamente la dosis de metadona hasta la mejora de los síntomas de abstinencia, con una dosis de 150 en el día 23 de evolución. La monitorización de los niveles plasmáticos mostró una caída desde 186 hasta 46 ng/ml al introducir los antiretrovirales y un retorno a los niveles previos con el ajuste de la dosis. Discusión. Los tratamientos habituales de la infección por VIH interaccionan con la metadona. El uso conjuntos de antiretrovirales puede producir efectos paradójicos, tanto de inducción como de inhibición a nivel del citocromo p450. La monitorización de los niveles plasmáticos puede ser una herramienta útil para el ajuste de la dosis de metadona en estos pacientes.
Interacción entre antiretrovirales (estavudina, indinavir, ritonavir, nevirapina) y metadona. A propósito de un caso.
(Interaction between antirretrovirals (stavudine, indinavir, ritonavir, nevirapine) and methadone. A case study. )
Gimeno C*; Esteban J**; Mora E*; Barril J**; Pellín MC**
* Unidad conductas Adictivas Area 15. Villajoyosa. Alicante (España).
**División de Toxicología, Universidad Miguel Hernández. Elche. Alicante. (España).
PALABRAS CLAVE: Niveles plasmaticos, Interacciones antirretrovirales, Enantiomeros metadona
(KEYWORDS: Plasma levels , Interctions antirretrovirals, Enantiomer methadone. )
página 1
[2/2/2003]
Resumen
Fundamentos. La población adicta a drogas por vía parenteral tiene una prevalencia de infección por el virus de la inmunodefieciencia humana del 65%. La metadona es un mórfico sintético, utilizado en el tratamiento de desintoxicación y mantenimiento en adictos a la heroína. No se conocen pautas de adaptación de la dosis de metadona en función del uso de antiretrovirales, aunque se han descrito interacciones individuales entre la metadona y estos fármacos.
Caso clínico. Paciente en tratamiento de mantenimiento con metadona con una dosis estabilizada y mantenida de 60 mg / día en el año previo. Inicia tratamiento con Zerit (estavudina) 1/12 h. Crixivan (indinavir) 2/12h, Norvir (ritonavir) 1/12h y Viramune (nevirapina) 1/12h. El cuarto día a partir del inicio de la medicación antirretroviral el paciente refiere síntomas compatibles con un síndrome de abstinencia a metadona: ansiedad, insomnio, diarrea, piloerección, vómitos y agitación. Se aumenta progresivamente la dosis de metadona hasta la mejora de los síntomas de abstinencia, con una dosis de 150 en el día 23 de evolución. La monitorización de los niveles plasmáticos mostró una caída desde 186 hasta 46 ng/ml al introducir los antiretrovirales y un retorno a los niveles previos con el ajuste de la dosis.
Discusión. Los tratamientos habituales de la infección por VIH interaccionan con la metadona. El uso conjuntos de antiretrovirales puede producir efectos paradójicos, tanto de inducción como de inhibición a nivel del citocromo p450. La monitorización de los niveles plasmáticos puede ser una herramienta útil para el ajuste de la dosis de metadona en estos pacientes.
Abstract
Background: The drug dependent population by parenteral injection has a prevalence of infection by the human immunodeficiency virus (HIV) of 65%. Methadone is a synthetical opioid drug used in the detoxification and maintenance treatment of heroin addicts. Guidelines for dose adjustment are not known with regard to the methadone dosing when combined with the use of antirretrovirals, but individual interactions between methadone and these drugs have been described.
Clinical case: Patient in methadone maintenance treatment with a stabilized dose of 60 mg methadone per day during the previous year. He began the treatment with Zerit (estavudine) 1/12 h, Crixivan (indinavir) 2/12 h, Norvir (ritonavir) 1/12 h and Viramune (nevirapine) 1/12 h. On the fourth day from the beginning of the antirretroviral therapy the patient showed symptoms compatible with a withdrawal syndrome to methadone: anxiety, insomnia, diarrhoea, piloerection, vomits and agitation. The dose of methadone was progressively increased until the improvement of the withdrawal symptoms, reading a dose of 150 mg/day. Monitoring of the plasma levels of R-methadone, the pharmacologically active enantiomer of methadone, showed a fall from 186 to 46 ng/ml after the antirretrovirals were introduced, and a return to the previous levels with the fitting of the dose.
Discussion: Current antirretroviral therapy for the HIV infection apparently interfere with methadone treatment. The combined use of antirretrovirals may produce paradoxical effects of induction and inhibition at the level of the cytochrome P450 system. Monitoring of R-methadone plasma levels can be a useful tool for the dose adjustment of methadone in patients receiving multiple antirretroviral therapy.
Fundamentos
La exposición crónica a opiáceos da lugar a importantes cambios comportamentales neuroadaptativos como son la tolerancia, la dependencia y la adicción. La metadona es un analgésico sintético, utilizado clínicamente como mezcla racémica de R- y S-metadona para el tratamiento de mantenimiento en adictos a la heroína. La dosis de metadona es un tema en estudio y debate. Inicialmente se tendió a la administración de dosis elevadas pasando posteriormente a dosis menores. En la actualidad se recomienda la individualización de las dosis ya que pacientes con dosis por debajo de niveles clínicos considerados como adecuados presentan una buena evolución y pacientes con dosis consideradas como eficaces no obtienen respuestas clínicas adecuadas.
Uno de los instrumentos utilizados para la valoración de las dosis terapéuticas son los niveles plasmáticos. Se considera que la dosis de metadona se encuentra en niveles plasmáticos útiles para el tratamiento cuando alcanza cifras por encima de 150 ng/ml, constituyendo el rango mínimo para mantener el estado de equilibrio. La concentración plasmática media óptima durante 24 horas se sitúa entre 400-600ng/ml siendo necesarias para suprimir toda acción de un opiáceo y para garantizar un mantenimiento estable (Dole, 1991: Jaffe 1995, Wolf 1991b; Parrino, 1997; Baño 1998).
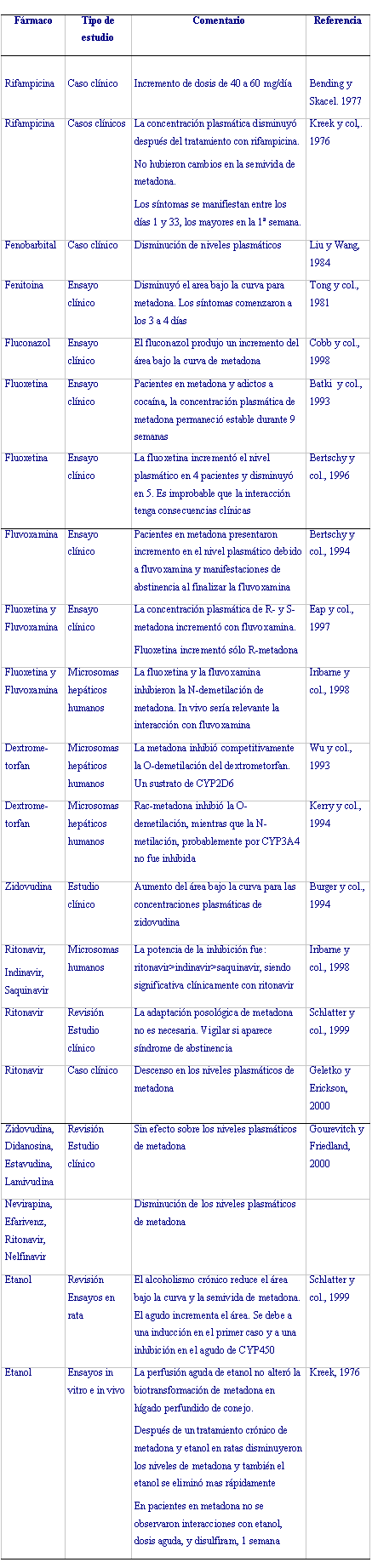
Los tratamientos de sustitución son generalmente de larga duración y además se realizan en pacientes con múltiples patologías comórbidas tanto orgánicas como psiquiátricas. Todo ello conlleva la utilización conjunta de metadona con un gran número de fármacos. Se han descrito interacciones con múltiples principios activos y con algunos antirretrovirales aunque existen algunas contradicciones entre los distintos estudios clínicos (Tabla 1).
Tabla 1 Interacciones entre metadona y otros compuestos
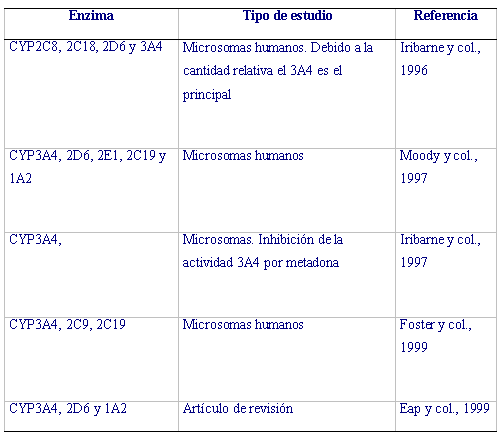
En el metabolismo de la mayoría de los fármacos interviene el citocromo P450. En la metabolización de la metadona se han implicado varias isoformas de este citocromo como son la CYP3A4, CYP2D6, CYP1A2, CYP2C9 y CYP2C19. El citocromo CYP3A4 es la isoforma mas abundante expresada en el hígado humano y la principal implicada en el metabolismo de metadona (Tabla 2). La isoforma CYP2D6 selectivamente metaboliza R-metadona.
Tabla 2 Citocromos implicados en el metabolismo de metadona
La población de pacientes usuarios de drogas por vía intravenosa presenta una alta comórbilidad de la infección por el virus de la hepatitis C y B así como por el virus de la Inmunodeficiencia Humana. ello conlleva la utilización simultanea de la metadona con pautas de combinaciones de antirretrovirales de reciente introducción en clínica.
Caso clínico
Paciente en tratamiento de mantenimiento con metadona que tras la introducción de nuevas pautas de fármacos antirretrovirales, presenta síndrome de abstinencia a opiáceos (SAO), así como una disminución en los niveles plasmáticos de metadona respecto a los niveles previos, necesitando aumentar 2, 5 veces la dosis inicial para resolver el SAO.
Varón de 33 años con historia de consumo de heroína intravenosa desde los 16 años. Tras varios intentos de tratamiento con antagonistas opiáceos y breves periodos de abstinencia, se inició tratamiento de mantenimiento con metadona en diciembre de 1996 de forma ininterrumpida, con una dosis mantenida de 60 mg / día. Desde hacía 10 años presentaba coinfección por virus de hepatitis B, hepatitis crónica por virus C. Infección por VIH conocida desde hace más de 11 años, en estadio C3 con nivel de CD4 de 150 y carga viral de 88. 000 copias, en tratamiento antirretroviral inicialmente con zidovudina (Retrovir® 250mg1/12h) Zalcitavina (Hivid ®1/8h). Posteriormente en junio de 1999 se modificó a Lamivudina (3TC Epivir® 1/12h), Estavudina, (D4T, Zerit 1/12h) y Nelfinavir (Viracept® 5/12h) con buen cumplimiento de las pautas medicamentosas y continuidad con citas hospitalarias, alcanzando niveles de CD4 de 566 y carga viral de 3000 copias, sin embargo tras el ascenso de la carga viral y la disminución de los linfocitos CD4 y la aparición de enfermedades oportunistas así como la realización de analíticas de resistencia genotípicas, se decidió el cambio de medicación a Estavudina (Zerit® 1/12h), Indinavir (Crixivan®) 2/12h) Ritonavir (Norvir ®, 1/12h, ) Nevirapina (Viramune® 1/12h).
A partir del cuarto día del inicio de la medicación antirretroviral el paciente refirió, escalofríos, sudoración, bostezos, lagrimeos, rinorrea, dolor lumbar, diarrea, piloerección, vómitos, agitación, frecuencia cardiaca de 68 pm, tensión arterial de 140/80, a pesar de la dosis habitual de metadona.
La dosis no se modificó debido a una decisión firme por parte del paciente de no incrementar la dosis. A las dos semanas (día 13) el paciente presentó los mismos síntomas de abstinencia que el cuarto día y accede a subir la dosis de la siguiente forma: 60mg por la mañana y 15 mg por la noche. A las tres semanas (día nº 22) siguió presentando los mismos síntomas de abstinencia descritos el cuarto día, la dosis de metadona se mantuvo en 60mg por la mañana y 15 mg por la noche, puesto que el paciente seguía presentando una gran resistencia a aumentar la dosis. Al día siguiente (día nº 23) el paciente acudió a consulta sin cita, llorando, con dificultades en su autocontrol, irritable con síntomas objetivos y subjetivos de abstinencia. No había podido dormir y refería comportamiento agresivo hacia las personas y cosas, así como conductas violentas y autoagresiones, se produjo un aumento progresivo de la dosis hasta lograr la remisión de los síntomas de abstinencia, desapareciendo la sintomatología con una dosis de 150 mg/día. El tratamiento antirretroviral no se modificó durante el periodo de seguimiento.
Se realizó la valoración clínica del SAO con la escala subjetiva de abstinencia a opiáceos (Handelsman, 1987; Hiltunen, 1995) y con la escala objetiva de abstinencia a opiáceos (Handelsman, 1987). Se determinaron los niveles plasmáticos de R-metadona, S-metadona, y sus respectivos metabolitos 2-etiliden-1, 5-dimetil-3, 3-difenil 1-pirrolidina (EDDP; R-EDDP y S-EDDP), en sangre y en orina, con electroforesis capilar. El cronograma de las medidas fue el siguiente: muestra basal antes de inicio de la toma de medicación antirretroviral, la segunda se tomo a los cuatro días, la tercera a las dos semanas, la cuarta a los tres semanas y la última al cuarto mes del inicio de la toma de los fármacos.
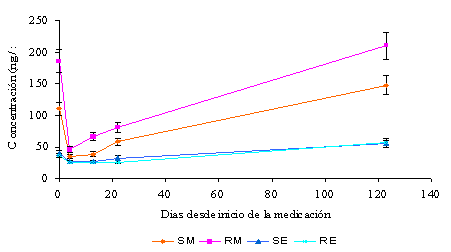
En la Figura 1 se observa la evolución temporal de los niveles plasmáticos de R-metadona, S-metadona, y los metabolitos de la metadona R-EDDP y S-EDDP. Se produjo una rápida e importante disminución en los niveles de R- y S-metadona y una disminución menor en los niveles de los enantiómeros del metabolito principal de la metadona EDDP.
A las tres semanas se observa un ligero aumento correspondiente al incremento de 15 mg en la dosis. Al cuarto mes los niveles que se obtiene corresponden aproximadamente a los iniciales, siendo 150 mg/día la dosis final y 60 mg/día la dosis antes de la toma de los antirretrovirales.
Figura 1 Evolución temporal de los niveles plasmáticos de R-metadona (RM), S-metadona (SM), R-EDDP (RE) y S-EDDP (SE) a partir de la introducción de medicación antirretroviral
De la determinaciones de analíticas de orina realizadas, en la figura 2, en la muestra correspondiente a las tres semanas, además de los picos correspondientes a S-metadona, R-metadona, S-EDDP y R-EDDP indicadores del cumplimiento del paciente con el tratamiento de mantenimiento con metadona, se observan dos picos más pequeños producto de un consumo de heroína y cocaína. De todas las muestras analizadas estas sustancias solo se observaron en esta determinación.
Figura 2 Electroforegrama de la muestra de orina correspondiente a las tres semanas de paciente en tratamiento con antirretrovirales
Se compararon las medias de los niveles plasmáticos basales, cuarto día, dos semanas, tres semanas, cuarto mes, mediante el test ANOVA de un factor, (Tabla 3). Los valores medios durante el cuarto día, dos semanas, y tres semanas no fueron estadísticamente diferentes en ninguno de los cuatro analitos. Estos valores fueron diferentes estadísticamente con los valores basales y cuarto mes para R-, S-metadona, además los niveles obtenidos basal y cuarto mes, fueron estadísticamente diferentes entre si para S-metadona, no presentando diferencia significativa en el caso de la R-metadona. Los niveles plasmáticos de R-EDDP de los días basal, cuarto día, dos semanas y tres semanas no fueron estadísticamente diferentes, siéndolo con los niveles de R-EDDP del cuarto mes.
Los niveles plasmáticos de S-EDDP fueron estadísticamente similares para los basales, cuarto día, dos semanas y tres semanas, asimismo también lo fueron para los basales y cuarto mes. Se observo que cuando se restablecieron los niveles plasmáticos de R-metadona a los niveles anteriores a la introducción de la nueva medicación antirretroviral (cuarto mes), el síndrome de abstinencia a opiáceos remitía. Durante los días 4, dos semanas y tres semanas, es decir, cuando los niveles plasmáticos de R-metadona diferían estadísticamente de los niveles del basal, el síndrome de abstinencia a opiáceos persistía.
Tabla 3 Comparación de medias de los niveles plasmáticos de R-metadona (RM), S-metadona (SM), R-EDDP (RE) y S-EDDP (SE) durante el seguimiento del paciente
Discusión
El ritonavir es un inhibidor de CYP 3A4 según se demostró en estudios in vitro (Iribarne, 1998), pero después de un tiempo en tratamiento se comporta como un inductor, con lo que aumenta la cantidad de enzima 3A4 y por tanto aumenta la biotransformación de metadona. Se han publicado estudios clínicos sobre la interacción entre ritonavir y metadona. Geletko y Erickson, (2000) observaron un descenso en los niveles plasmáticos de metadona en un paciente que empezó a presentar síntomas de abstinencia 7 días después de comenzar una pauta posológica que incluía ritonavir. Schlatter (1999) sugiere que la adaptación posológica de metadona no es necesaria en la instauración de la medicación y que se debe vigilar la aparición de síntomas de abstinencia.
Según describió Bertz (1997), el ritonavir inhibe 3A, 2D6, 2C9 y quizá 2C19. Además el tratamiento con ritonavir se ha asociado con una autoinducción de CYP3A y con efectos en CYP1A2 y glucuroniltransferasa. Cuando ambos procesos inducción o inhibición están presentes el efecto neto será positivo o negativo. En el caso de la interación de ritonavir con el enzima 3A la inhibición es el factor dominante. A nivel del citocromo CYP1A se produce una inducción. La inhibición y la inducción son procesos que pueden aparecer en diferente momento en un curso temporal. La inhibición ocurre instantáneamente y la inducción después de varios días, por la formación de nuevas moléculas de enzima.
Varias publicaciones recogen la interacción entre nevirapina y metadona (Gourevitch 2000; Baño, 2000). La nevirapina induce síntomas de abstinencia y disminuye los niveles plasmáticos de metadona requiriendo incrementos de dosis de alrededor del 20% (Clarke, 2000).
Los estudios de Dole y Jaffe han afirmado la necesidad de unos niveles mínimos de metadona en suero entre 150-600 ng/ml, si bien estos no han sido validados todavía. La metadona se suministra como una forma racémica de dos enantiomeros R y S-metadona, el contenido es el 50% de cada enantiómero, y se ha observado que la concentración en suero de la forma activa, la R-metadona varia entre 1 y 17 veces
Por tanto, en nuestro paciente, la disminución en los niveles plasmáticos de la forma activa la R-metadona se produjo probablemente como consecuencia de la suma de interacciones inductoras del ritonavir y nevirapina. Esta interacción afectó de forma diferente a R-metadona y a S-metadona, ya que los niveles de S-metadona fueron más altos al cuarto mes con respecto al basal, mientras que los de R-metadona fueron estadísticamente similares.
Por otro lado, la sintomatología de abstinencia había remitido totalmente al cuarto mes. Considerando que la concentración a tener en cuenta por su acción terapéutica es la de R-metadona se concluyó que en este caso, fue necesario un aumento de la dosis hasta 150 mg / día, 2. 5 veces mayor que la dosis inicial, para estabilizar al paciente y obtener un nivel plasmático equivalente al nivel previo.
El análisis de los niveles plasmáticos aporta resultados novedosos respecto a estudios previos. En primer lugar, la determinación enantioselectiva permite determinar R-metadona, el enantiomero que produce fundamentalmente el efecto farmacológico deseado. Por lo tanto la determinación de R-metadona puede ser un indicador más certero de las variaciones clínicas, que la determinación de metadona racémica, ya que el metabolismo de la metadona podría ser enantioselectivo, como por ejemplo, el mediado por el citocromo P450 2D6.
En segundo lugar, al realizar el seguimiento a un paciente, los niveles plasmáticos de metadona en un determinado momento se comparan con los niveles plasmáticos de metadona cuando el tratamiento de mantenimiento con metadona es estable y óptimo para el paciente. De ese modo se elimina la variabilidad interindividual del estudio, factor importante ya que el metabolismo mediado por las isoformas del citocromo P450 está sujeto a una gran variabilidad interindividual.
Torrens, et al 1998 encontraron que la monitorización de metadona racémica no era útil para predecir la presencia de los síntomas de abstinencia a opiáceos cuando realizaron un análisis de regresión logística para correlacionar la concentración de metadona racémica en plasma y la puntuación de la escala Short Opiate Withdrawal Scale. Sin embargo este resultado puede estar sujeto a la metodología aplicada, ya que se utilizó la determinación de metadona racemíca, no la R metadona y realizó un diseño transversal para validar su hipótesis.
Bibliografía
Baño MD. (1998) Tras la Huella de la metadona. Madrid
Baño Rodrigo MD, Agujetas Rodríguez M, Lopez Garcia ML, Guillén Llera JL. (2000) La nevirapina induce síntomas de abstinencia en pacientes en programa de mantenimiento con metadona con infección por VIH. Revista Clínica Española 200(1):18-20
Batki SL, Manfredi LB, Jacob P, Jones RT. (1993). Fluoxetine for cocaine dependence in methadone maintenance: Quantitative plasma and urine cocaine/benzoylecgonine concentrations. Journal of clinical psychopharmacology dos semanas:243-250.
Bending, MR; Skacel, PO. (1977). Rifampicin and methadone withdrawal. The Lancet. 1211.
Bertschy, G; Eap, CB; Powell, K; Baumann, P. (1996). Fluoxetine addition to methadona in addicts: pharmacokinetic aspects. Ther. Drug Monit. 18(5): 570-572.
Bertschy, G; Baumann, P, Eap, CB; Baetting D; . (1994). Probable metabolic interaction between methadone and fluvoxamine in addict patients. Ther. Drug Monit. 16: 42-45.
Bertz RJ, Granneman GR. (1997) Use of in vitro and vivo data to estimate likelihood of metabolic pharmacokinetic interations. Drug Interactions 32:210-258.
Burger, DM; Meenhorst, PL; Ten Napel, CHH; Mulder, JW; Neef, C; Koks, CHW; Bult, A; Beijnen, JH. (1994). Pharmacokinetic variability of zidovudine in HIV-infected individuals: subgroup analysis and drug interactions. AIDS. 8: 1683-1689.
Cobb, MN; Desai, J; Boown, LS; Zannikos, PN; Rainey, PM; (1998). The effect of fluconazole on the clinical pharmacokinetics of methadone. Clinical Pharmacology & Therapeutics. 63(6): 655-662.
ClarKe, S; Mulchy, F; Back, S; Gibbons, S; Tjia, J; Barry, M (2000) Managing Tethadone and Nucleoside Reverse Trascriptase Inhibitors: Guilelines for Clinical Practice (abstract nº 88) 7th Conference on Retroviruses and Opportunistic Infections. San Francisco. California.
Dole, VP; Foreword. In The effectivenee of Methadone Maintenance Treatment (Ball JG and Ross A eds) pp VII-VIII. Springer. New York.
Eap, CB; Bertschy, G; Powell, K; Baumann, P. (1997). Fluvoxamine and fluoxetine do not interact in the same way with the metabolism of the enantiomers of methadone. Journal of Clinical psychopharmacology. 17(2): 1dos semanas-117.
Eap, CB; Déglon JJ; Baumann, P. (1999) Pharmacokinetics and pharmacogenetics of methadone: clinical relevance. Heroin Add and Rel Clin Probl 1:19-34.
Foster, DJR; Somogyi, AA; Bochner, F. (1999). Methadona N. demethylation in human liver micrrosomes: lack of stereoselectivity and involvement of CYP3A4. Br J Clin Parmacol. 47: 403-412.
Geletko, SD; Erickson, AD. (2000). Decreased methadone effect after ritonavir initiation. Pharmacotherapy. 20(1): 93-94.
Gourevitch MN & Friedland GH. Interactions between methadone and medications used to treat HIV infection: A review. (2000) The Mount Sinai Journal of Medicine 67(5): 429-436.
Greenblatt, DJ; Von Moltke, LL; Schmider, J; Harmatz, JS; Shader, RI. (1996). Inhibition of human cytochrome P450 3A isoforms by fluoxetine and norfluoxetine: in vitro and in vivo studies. J Clin Pharmacol. 36: 792-798.
Handelsman L, Cockrane KJ, Aronson MJ, Ness R, Rubinstein KJ, Kanof PD. (1987) Two new rating scales for opiate withdrawal. Am J Drug alcohol Abuse. dos semanas:293-308.
Hiltunen AJ, Lafolie P, Martel J, Ottosson F, Boreus LO, Beck O, Borg S, Hjemdahl P. (1995). Subjective and objective symptoms in relation to plasma methadone concentration in methadone patients. psychopharmacology 118:1tres semanas -126.
Iribarne, C; Berthou, F; Baird, S; Dreano, Y; Picart, D; Bail, JP; Beaune, P; Menez, JF. (1996). Involvement of cytocrome P450 3A4 enzyme in the N-demethylation of methadone in human liver microsomes. Chem. Res. Toxicol. 9: 365-373.
Iribarne, C; Dreano, Y; Bardou, LG; Menez, JF; Berthou, F. (1997). Interaction of methadone with substrates of human hepatic cytochrome P450 3A4. Toxicology. 117: dos semanas-23.
Iribarne, C; Berthou, F; Carlhant, D; Dreano, Y; Picart, D; Lohezic, F; Riche, C. (1998). Inhibition of methadone and buprenorphine N-delkylations by three HIV-1 protease inhibitors. Drug Metabolism and Disposition. 26 (3): 257-260.
Iribarne, C; Picart, D; Dreano, Y; Berthou, F. (1998). In vitro interactions between fluoxetine or fluvoxamine and methadone or buprenorphine. Fundam. Clin. Pharmacol. 12: 194-199.
Jaffe, JH. (1995) Opioid-related disorders. En Kaplan HI, Sadock BJ. Eds. Comprensive Texbook of Psiquiatric . (6ª ed) Baltimore. Williams and Wilkins.
Kerry, NL; Somogyi, AA; Bochner, F; Mikus, G. (1994). The role of CYP2D6 in primary and secondary oxidative metabolism of dextromethorphan: in vitro studies using human liver microsomes. Br J Clin Pharmc. 38: 243-248.
Kreek, MJ; Garfield, JW; Gutjahr, CL; Giusti LM. (1976). New Engl J Med. 294:1104-1106.
Kristensen, K; Blemmer, T; Angelo, HR; Christrup, LL; Drenck, NE; Rasmussen, SN; Sjogren, P. (1996). Stereoselective Pharmacokinetics of methadone in chronic pain patients. Therapeutic Drug Monitoring. 18: tres semanas 1-tres semanas 7.
Kristensen K, Christensen CB, Christrup LL. (1995). The mu1, mu2, delta, kappa opioid receptor binding profiles of methadone stereoisomers and morphine. Life sciences 2:45-50.
Lafolie, P; Beck, O; Blennow, G; Boreus, L; Borg, S; Elwin, CE; Karlsson, L; Odelius, G, Hjemdahl, P. (1991). Importance of creatinine analyses of urine when screening for abused drugs. Clin. Chem. 37 (11): 1927-1931.
Liu, SJ; Wang, RIH. (1984). Case report of barbiturate-induced enhancement of methadone metabolism and withdrawal syndrome. Am J Psychiatry 141(10) 1287-1288.
Moody DE, Alburges ME, Parker RJ, Collins JM, Strong JM. (1997) The involvement of cytrochrome P450 3A4 in the N-demethylation of L-acetylmethadol (LAAM), norLAAM, and methadone. Drug metabolism and disposition 25:dos semanas47-dos semanas53.
Parrino, MW. (1997) Manual de tratamiento con metadona . Barcelona . Ed IGIA.
Reisine, T; Pasternak, G. (1996). Analgésicos opiodes y sus antagonista. Goodman y Gilman . Las bases Farmacológicas de la terapéutica (pp. 557-591). Mc Grau Hill - Interamericana, 9ª Edición. 1996. 2 tomos.
Schlatter, J; Madras, JL; Saulnier, JL; Pojade, F. (1999). Interactions medicamenteuses avec la methadone. La Presse Medicale. 28(25): dos semanas81-dos semanas84.
Tong, TG; Pond, SM; Kreek MJ; Jaffery, NF; Benowitz, NL. (1981). Phenytoin-induced methadone withdrawal. Annals of Internal Medicine. 94: 349-351.
Torrens M, Castillo C, San L, del Moral E, Gonzalez ML, de la Torre R. (1998) Plasma methadone concentrations as an indicator of opioid withdrawal symptoms and heroin use in a methadone maintenance program. Drug alcohol Depend Nov 1; 52(3):193-200.
Verebely K, Volavka J, Mulé S, Resnick R. (1975). Methadona in man: Pharmacokinetic and excretion studies in acute and chronic treatment. Clin Pharmacol Ther 18:180-90.
Wolff, K; Hay, A; Raistrick, D. (1991a). High-dose methadona and the need for drug measurements in plasma. Clin. Chem. 37(9):1651-1664.
Wolff, K; Sanderson, M; Hay, A; Raistrick, D. (1991b). Methadone concentrations in plasma and their relationship to drug dosage. Clin. Chem. 37(2): 205-209.
Wu, D; Otton, SV; Sproule, BA; Busto, U; Inaba, T; Kalow, W; Sellers, EM; (1993). Inhibition of human cytochrome P450 2D6 (CYP2D6) by methadone. Br J Clin Pharm 35: 30-34.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.