Objetivos: Conocer si se han producido cambios conductuales asociados a disfunción fronto-subcortical en pacientes con enfermedad de Parkinson (EP) intervenidos de Estimulación Cerebral Profunda (ECP) bilateral del núcleo Subtalámico (NST).
Metodología: Sujetos: Un grupo de pacientes con EP avanzada tras 24 meses de ECP bilateral del NST, compuesto por N=13 (8 varones), de 53, 62±7, 27 años de edad, 13, 7±3, 7 años de evolución, tratados con 1178±322 mg/día de dosis equivalente de levodopa, y una educación de 4, 77±3, 96 años de escolarización; y un grupo de familiares N=13 (8 mujeres), cuidadores principales de los pacientes.
Procedimiento: Se administró la FrSBe a pacientes y familiares tras 24 meses de la cirugía. Esta prueba evalúa la conducta asociada a disfunción en los circuitos fronto-subcorticales, a través de las escalas de apatía, desinhibición y disfunción ejecutiva, así como una puntuación global. Paciente y familiar informan sobre sintomatología "frontal" presente antes de la cirugía y tras ésta. Se administró en un contexto más amplio de evaluación neuropsicológica. Se realizaron análisis de varianza (ANOVA) de medidas repetidas. Resultados: No se encontraron diferencias estadísticamente significativas entre los autoinformes de pacientes y familiares ni entre el estado prequirúrico y tras 24 meses en las escalas de la FrSBe.
Conclusiones: Los resultados indican que los pacientes con EP tras 24 meses de ECP bilateral del NST muestran un comportamiento asociado a disfunción en circuitos fronto-subcorticales similar al observado antes de la cirugía. Se observa una elevada concordancia entre lo informado por los pacientes y sus familiares.
Escala conductual de sistemas frontales (FrSBe) en pacientes con enfermedad de Parkinson: Resultados a los 24 meses de estimulación bilateral del núcleo subtalámico.
M. Meersmans Sánchez-Jofré a/b; Á. López Jiménez b; F. Escamilla Sevillaa; M. Jouma Katatia; S. Santiago Ramajob; A. Mínguez Castellanos a, J. M. Martín Linares a; V. Arjona morón a; M. Pérez Garcíab.
a) hospital Universitario Virgen de las Nieves, Granada. España.
b) Dpto. personalidad, Evaluación y tratamiento Psicológico. Universidad de Granada. España.
Resumen
Objetivos: Conocer si se han producido cambios conductuales asociados a disfunción fronto-subcortical en pacientes con enfermedad de Parkinson (EP) intervenidos de Estimulación Cerebral Profunda (ECP) bilateral del núcleo Subtalámico (NST).
Metodología: Sujetos: Un grupo de pacientes con EP avanzada tras 24 meses de ECP bilateral del NST, compuesto por N=13 (8 varones), de 53, 62±7, 27 años de edad, 13, 7±3, 7 años de evolución, tratados con 1178±322 mg/día de dosis equivalente de levodopa, y una educación de 4, 77±3, 96 años de escolarización; y un grupo de familiares N=13 (8 mujeres), cuidadores principales de los pacientes.
Procedimiento: Se administró la FrSBe a pacientes y familiares tras 24 meses de la cirugía. Esta prueba evalúa la conducta asociada a disfunción en los circuitos fronto-subcorticales, a través de las escalas de apatía, desinhibición y disfunción ejecutiva, así como una puntuación global. Paciente y familiar informan sobre sintomatología “frontal” presente antes de la cirugía y tras ésta. Se administró en un contexto más amplio de evaluación neuropsicológica. Se realizaron análisis de varianza (ANOVA) de medidas repetidas. Resultados: No se encontraron diferencias estadísticamente significativas entre los autoinformes de pacientes y familiares ni entre el estado prequirúrico y tras 24 meses en las escalas de la FrSBe.
Conclusiones: Los resultados indican que los pacientes con EP tras 24 meses de ECP bilateral del NST muestran un comportamiento asociado a disfunción en circuitos fronto-subcorticales similar al observado antes de la cirugía. Se observa una elevada concordancia entre lo informado por los pacientes y sus familiares.
Introducción
La enfermedad de Parkinson (EP) es un trastorno neurológico del movimiento, crónico y progresivo, provocado por la degeneración neuronal de la sustancia nigra, lo que conlleva una disminución en los niveles de dopamina. Los síntomas guías son el temblor, rigidez y bradicinesia, existiendo una amplia variedad de sintomatología. Su inicio es insidioso, lo cual dificulta su diagnóstico, iniciándose de forma unilateral y evolucionando hacia la bilateralidad. Su etiología es desconocida y probablemente multifactorial. Pueden estar implicados factores genéticos, ambientales, daño oxidativo y envejecimiento acelerado cerebral u apoptosis. Tiene la misma distribución de etnia y sexo. La edad media de comienzo se sitúa en torno a los 55 años aunque existen formas tempranas de la enfermedad (un 5-10% de los pacientes tienen menos de 40 años) (1-2).
A pesar de la minuciosa descripción que realizó James Parkinson en 1917 sobre la parálisis Agitante (An Essay on the Shaking Palsy) no acertó al final de ésta, cuando dice que los sentidos y el intelecto permanecen indemnes: “Involuntary tremulous motion, with lessened muscular power, in parts not in action and even when supported; with a propensity to venid the trunk forward, and to pass from a walking to a running pace: the senses and intellects being uninjuried” (3).
La afectación de las funciones neuro-cognitivas en los pacientes con EP excede al detrimento normal propio del envejecimiento (4). De la sintomatología no motora, los síntomas cognitivos han sido los más investigados en la EP, a través de la propia evolución de ésta y su correlato anatomopatológico mediante técnicas de neuroimagen, de su relación con el tratamiento médico (principalmente levodoterapia), y con el tratamiento quirúrgico (principalmente cirugía lesional y estimulación cerebral profunda, y recientemente cirugía neuro-restauradora). La presencia de alteraciones cognitivas se puede presentar en un continuum que comprende un extremo en el que se encuentran pacientes con EP que no muestran déficit cognitivo, hasta el extremo donde el declive degenera en una demencia generalmente de tipo sub-cortical (5). La prevalencia de demencia en la EP encontrada en diferentes estudios es muy inconstante, con cifras que oscilan entre el 4 y el 93% (4-6). Son muchos los investigadores que han sobreestimado la prevalencia de demencia en la EP al utilizar criterios de investigación muy laxos para diagnosticar la demencia, y mediante técnicas poco específicas. No se debe confundir la presencia de trastorno cognitivo específico y/o generalizado, muy frecuente en la EP, con el desarrollo inicial de un cuadro demencial.
Cuando la edad del paciente con EP es mayor, se incrementa la duración de la enfermedad, y avanza el estadio evolutivo, se produce una correlación con una mayor depresión y una capacidad cognitiva más reducida (7). La amplia variedad de síntomas asociados a la EP y a su manejo terapéutico afecta al bienestar físico, social y psicológico del paciente que ve aumentados sus déficit disminuyendo progresivamente su calidad de vida (8) y la de sus cuidadores (9).
El patrón de trastornos cognitivos que suele presentarse es de tipo funcional fronto-estriatal, acorde a los circuitos implicados, manifestándose los trastornos cognitivos específicos de una manera aislada o de manera sindrómica y mostrando diferentes grados de afectación. La disfunción de los circuitos fronto-subcorticales característica de la EP parece ser una de las posibles causas de la disfunción ejecutiva que suelen presentar. Algunos autores sugieren que los trastornos neuropsicológicos de los pacientes con EP no demenciados son explicados por la disfunción ejecutiva secundaria a la afectación fronto-subcorical (10).
El funcionamiento ejecutivo es considerado como el responsable de los aspectos cognitivos más complejos ya que también posee la función de supervisión de la cognición. Entre las capacidades cognitivas más investigadas dentro del constructo de funciones ejecutivas destacamos las habilidades de “Planificación”, “Flexibilidad mental”, “Memoria de trabajo”, “Monitorización” e “Inhibición de respuesta”. Según Lezak (11) se pueden distinguir cinco subprocesos asociados a las funciones ejecutivas: voluntad, planificación, acción dirigida a objetivos, auto-regulación y ejecución efectiva. Ver tabla 1.
Tabla 1. Problemas relacionados con los subprocesos asociados a las funciones ejecutivas
Asimismo, Cummings distingue los déficits asociándolos a la disfunción en los distintos circuitos prefrontales-subcorticales: Circuito pre-frontal dorso-lateral, Circuito lateral órbito frontal y Circuito del cíngulo anterior (12-14). Ver tabla 2.
Tabla 2. Déficits asociados a la disfunción en distintos circuitos fronto-suborticales
Por otra parte, consideramos que un paciente tiene EP avanzada cuando presenta complicaciones de difícil control con el tratamiento médico. La cirugía funcional está indicada si existe una discapacidad con repercusión en la calidad de vida, derivada de la intensidad de la clínica parkinsoniana motora y de la duración y severidad de las complicaciones motoras de la levodopaterapia crónica (15).
Mediante el tratamiento quirúrgico funcional, concretamente la estimulación bilateral del núcleo subtalámico (NST), se pretende producir una inhibición localizada en determinados núcleos cerebrales profundos (NST), con el objetivo de mejorar algunas de las manifestaciones motoras de la enfermedad. No obstante, el efecto inhibitorio en el NST va afectar secundariamente a las proyecciones que conectan con el lóbulo frontal (Corteza prefrontal dorso lateral) ya sea vía directa por la SNr e indirectamente mediante la vía GPi y tálamo y también recibe inputs directamente desde el cortex. El NST soporta las vías asociativa y límbica participando en el circuito cortico-striato-talamo-cortical (16).
En la actualidad, todas las revisiones que recogen la praxis en el tratamiento quirúrgico de la EP consideran necesaria la evaluación neuropsicológica antes de la intervención, integrándola dentro del proceso de selección del candidato a cirugía, y después de la intervención, en el seguimiento y manejo de los posibles cambios que puedan haber ocurrido, ya sean cognitivos, emocionales y/o comportamentales (17-21).
La mayoría de las investigaciones coinciden en que la Estimulación Cerebral Profunda (ECP) bilateral del NST es un procedimiento por el cual se obtiene una importante mejoría de los síntomas motores de la enfermedad, siendo el balance muy positivo. En la mayoría de los casos el beneficio motor es evidente, en cambio, la repercusión que tiene la cirugía y la posterior estimulación bilateral del NST sobre las esferas cognitiva, emocional y comportamental no son del todo concluyentes (22-23).
La revisión de la literatura muestra una evidente heterogeneidad de cambios neuropsicológicos tras ECP del NST, posiblemente debido a las diferentes formas de proceder, desde la selección del candidato, pasando por el procedimiento quirúrgico hasta las distintas metodologías empleadas en los estudios. Se ha informado de deterioros en las funciones cognitivas (frontales/ejecutivas, atención, fluidez verbal, aprendizaje, memoria y función viso-perceptiva), emocionales (depresión, ansiedad) o conductuales (apatía, suicidio, rasgos obsesivo-compulsivos, alucinaciones, psicosis, hipomanía). El hallazgo más consistente en la literatura a nivel cognitivo es el deterioro postquirúrgico en fluencia verbal, aunque con menor consistencia también se han descrito déficits en medidas de aprendizaje y memoria. Sin embargo, la afectación de sintomatología conductual y/o de personalidad “frontal” asociada a la ECP del NST es un trastorno que puede incapacitar al paciente y a su familia. A nivel emocional destaca la estrecha relación que mantiene la colocación del electrodo y de los parámetros de la estimulación sobre el estado emocional (20, 24-30). También se ha puesto de manifiesto el mayor riesgo de alteraciones neuropsicológicas postquirúrgicas que presentan los candidatos de edad más avanzada, con más años de evolución y que presentan o han presentado alteraciones cognitivas y/o psicopatológicas.
Por otra parte, hay investigaciones que indican la seguridad y eficacia de la ECP del NST sin comprometer la función neuropsicológica (31-32). Sin embargo, tal y como concluyen en diversas revisiones del impacto de la ECP del NST en las funciones cognitivas y neuroconductuales, la evidencia empírica sobre los efectos únicamente acaba de comenzar (21, 33).
Por tanto se hace necesario el estudio a largo plazo de los efectos que produce la ECP del NST en el funcionamiento neuropsicológico de los pacientes intervenidos. Además, se hace patente la idoneidad de utilizar instrumentos psicométricos ecológicos, que evalúen el funcionamiento real del paciente dentro de su contexto, y que a su vez sea posible compararlo con su funcionamiento previo y contrastarlo mediante la recogida de información tanto del paciente como del cuidador.
Objetivos
Conocer si se han producido cambios conductuales asociados a la disfunción fronto-subcortical en pacientes con EP avanzada intervenidos tras 24 meses mediante Estimulación Cerebral Profunda (ECP) bilateral del núcleo Subtalámico (NST).
Tabla 1. Datos socio-demográficos y clínicos de la muestra de pacientes con EP y sus familiares ª
Metodología
Sujetos: La muestra estaba compuesta por un grupo de pacientes con EP avanzada que habían sido intervenidos hace 24 meses de ECP bilateral del NST y un grupo de familiares que conviven con el paciente.
Los 13 pacientes (8 varones y 5 mujeres) tenían una edad media de 53, 62±7, 27 años; y tenían una educación de 4, 77±3, 96 años de escolarización. Presentaban 13, 7±3, 7 años de evolución de la EP, y mostraban una puntuación en la sub-escala motora de la escala Unificada de la enfermedad de Parkinson (UPDRS-III) evaluada en “off” (sin medicación) de 36, 14±8, 47. La dosis equivalente de levodopa era de 1178±322 mg/día.
Los 13 familiares (8 mujeres y 5 varones) tenían una edad media de 49±18, 82, y una educación inferior a 7 años de escolarización. Todos ellos eran los cónyuges y acompañantes de los pacientes durante todo el proceso pre-quirúrgico y de seguimiento. Los datos descriptivos de la muestra se presentan en la tabla 1.
Procedimiento
Se administró la escala Conductual de Sistemas Frontales (FrSBe) (34-35) a pacientes y familiares tras 24 meses de la cirugía. La FrSBe es un inventario autoaplicado de 46 items que evalúa las características conductuales y de personalidad asociadas a la disfunción de los circuitos fronto-subcorticales. A mayor puntuación más percepción de conductas “frontales”. Tiene dos versiones, una para el paciente y otra para el familiar, en la que informan retrospectivamente sobre la conducta del paciente antes y después de un hecho (cirugía). Se evaluó la conducta del paciente antes de la intervención quirúrgica y en el momento actual (tras 24 meses de ECP del NST). La puntuación total esta compuesta por tres sub-escalas: apatía, desinhibición y disfunción ejecutiva, las cuales se corresponden con el funcionamiento asociado a los circuitos prefrontales cingulado anterior, orbitolateral y dorsolateral. Tanto los pacientes como los familiares rellenaron la prueba de forma independiente y supervisados por un neuropsicólogo. La administración de la escala se llevó a cabo en un contexto más amplio de evaluación neuropsicológica. La FrSBe ha sido utilizada en diversas patologías (esquizofrenia, EP, enfermedad de Alzheimer, enfermedad de Huntington, esclerosis múltiple, demencia vascular) que presentan trastornos conductuales “frontales” mostrando de esta forma una adecuada validez de constructo (36-39).
Para el análisis estadístico se utilizó el paquete informático SPSS (Stadistical Package for Social Sciences) en su versión 13. 0 para Windows. Se llevaron a cabo análisis de varianza (ANOVA) de medidas repetidas entre las puntuaciones directas de la puntuación global de la FrSBe y de las sub-escalas de apatía, desinhibición y disfunción ejecutiva obtenidas por el paciente y su familiar, respecto al estado prequirúrgico y tras 24 meses de ECP biltateral del NST.
Resultados
Para estudiar las diferencias en el resultado de la FrSBe relacionadas entre el paciente con EP y su familiar, las puntuaciones directas de cada una de las subescalas de la FrSBe fueron sometidas a análisis de varianza para medidas repetidas (ANOVA), con el grupo (Pacientes con EP vs. Familiares) como factor inter-sujetos, y el momento de la evaluación (antes de la cirugía vs 24 meses post-quirúrgico) como factor intrasujetos.
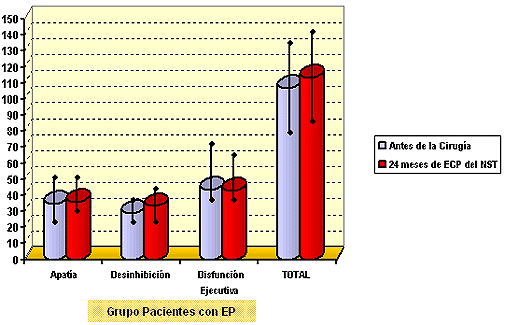
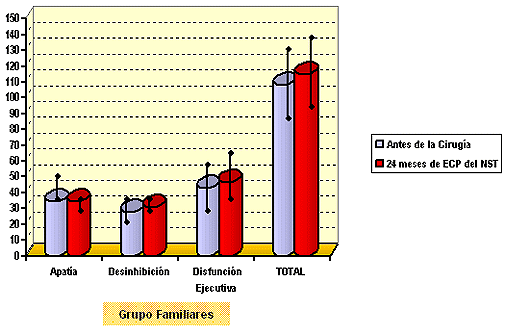
No se encontraron diferencias estadísticamente significativas (p<0, 05) entre los auto-informes de los pacientes y familiares ni entre el estado prequirúrico y tras 24 meses en ninguna de las sub-escalas de la FrSBe ni en la puntuación total. Ver las figuras 1 y 2.
Figura 1. - media y desviación estándar de las puntuaciones directas de la FrSBe en el grupo de pacientes con EP
Figura 2. - media y desviación estándar de las puntuaciones directas de la FrSBe en el grupo de familiares de pacientes con EP
Conclusiones
Los resultados indican que los pacientes con EP tras 24 meses de ECP bilateral del NST muestran un comportamiento asociado a disfunción de los circuitos fronto-subcorticales que no difiere significativamente al observado antes de la intervención quirúrgica. Además, se observa un elevado grado de correspondencia entre lo informado por los pacientes y sus familiares.
Por una parte, podemos inferir que tras el procedimiento quirúrgico en sí y la estimulación crónica bilateral del NST no se producen cambios de personalidad o de sintomatología conductual asociados a los lóbulos frontales. La estabilidad de las conductas “frontales” indica que tras 24 meses de ECP no se producen variaciones en las dimensiones de apatía, desinhibición o disfunción ejecutiva, propias de la disfunción fronto-subcortical.
Por otra parte, los pacientes con EP perciben de forma similar que sus familiares, su conducta “frontal” antes de la cirugía, y tras 24 meses de ECP bilateral del NST, descartándose por tanto la anosognosia.
Por último, dado que la mayoría de investigaciones estudian los efectos de la ECP a corto plazo (6-18 meses) consideramos necesario que se continúe el estudio de los efectos que tiene la ECP a largo plazo en el funcionamiento neuropsicológico evaluando el impacto que produce en el comportamiento de los pacientes con EP.
Bibliografía
1. Levine CB, Fahrbach KR, Siderowf AD, et al. Diagnosis and Treatment of Parkinson´s Disease: A Systematic Review of the Literature. Rockville:Agency for Healthcare Research and Quality; 2003.
2. Guttman M, Kish SJ, Furukawa Y. Current concepts in the diagnosis and management of Parkinson´s disease. CMAJ 2003; 4:293-301.
3. Parkinson J. An essay on the shaking palsy. Parkinson J, ed. London: Whittingham and Rowland; 1817.
4. Cummings JL. Subcortical dementia. New York: Oxford University Press; 1990.
5. Cummings JL. Subcortical dementia neuropsychology, neuropsychiatry and pathophysiology. British Journal of Psychiatry 1986; 149:682-97.
6. Pirozzolo F, Hansch C, Mortimer J. Dementia in Parkinson Disease: neuropsychological analysis. Brain and Cognition 1982; 1:71-83.
7. Kuopio AM, Marttila RJ, Helenius H, Toivonen M, Rinne UK. The Quality of Life in Parkinson´s Disease. Movement Disorders 2000; 15:216-223.
8. Schrag A, Jahanshahi M, Quinn N. How does Parkinson´s disease affect quality of life? A comparison with quality of life in the general population. Mov Disord 2000; 15(6):1112-8.
9. Aarsland D, Bronnick K, Ehrt U, De Deyn PP, Tekin S, Emre M, Cummings JL. Neuropsychiatric symptoms in patients with Parkinson's disease and dementia: frequency, profile and associated care giver stress. J Neurol Neurosurg Psychiatry 2007 Jan; 78(1):36-42.
10. Della Sala S. Cognitive deficits of Parkinsonians and Occam’s Razor. Europa Medicophysica 1988; 24:1-22.
11. Lezak MD, Howieson DB, Loring DW. Neuropsychological Assessment. 4th ed. New York: Oxford University Press; 2004.
12. Cummings JL. Frontal-subcortical circuits and human behavior. Annals of Neurology 1993; 50:873-880.
13. Tekin S, Cummings JL. Frontal-subcortical neuronal circuits and clinical neuropsychiatry: an update. J Psychosom Res 2002; 53(2):647-54.
14. Cummings JL. Anatomic and behavioral aspects of frontal-subcortical circuits. Ann N Y Acad Sci 1995; 769:1-13.
15. Hallet M, Litvan I. Evaluation of surgery for Parkinson´s disease. A report of the therapeutics and technology assessment subcommittee of the American Academy of Neurology. Neurology 1999; 53:1910-1921.
16. Alexander GE, DeLong MR, Strick PL. Parallel organization of functionally segregated circuits linking basal ganglia and cortex. Annual Review of Neuroscience 1986; 9:357-381.
17. Fields JA, Troster AI. Cognitive outcomes after deep brain stimulation for Parkinson´s disease: a review of initial studies and recommendations for future research. Brain and Cognition 2000; 42:268-293.
18. Lang AE, Widner H. Deep Brain Stimulation for Parkinson´s Disease: Patient selection and evaluation. Movement Disorders 2002; 17(3): S94-S101.
19. Pillon B. Neuropsychological assessment for management of patients with deep brain stimulation. Movement Disorders 2002; 3:S116-S122.
20. Saint-Cyr JA, Trépanier LL, Kumar R, Lozano A. Neuropsychological consequences of chronic bilateral stimulation of the subthalamic nucleus in Parkinson´s disease. Brain 2000; 123: 2091-2108.
21. Woods SP, Fields JA, Troster AI. Neuropsycological sequale of subthalamic nucleus deep brain stimulation in Parkinson´s disease: a critical review. Neuropsychological Review 2002; 12:111-126.
22. Abosch A, Lozano A. Stereotactic Neurosurgery for Movement Disorders Can. J Neurol Sci 2003; 30(1):S72S82.
23. Saint-Cyr JA. Neuropsychology for Movement Disorders Neurosurgery Can. J. Neurol. Sci. 2003; 30(1):S83-S93.
24. Castelli L, Perozzo P, Zibetti M, Crivelli B, Morabito U, Lanotte M, Cossa F, Bergamasco B, Lopiano L. Chronic deep brain stimulation of the subthalamic nucleus for Parkinson's disease: effects on cognition, mood, anxiety and personality traits. Eur Neurol 2006; 55(3):136-44.
25. Dujardin K, Defebvre L, Krystkowiak P, Blond S, Destee A. Influence of chronic bilateral stimulation of the subthalamic nucleus on cognitive function in Parkinson´s disease. Journal of Neurology 2001; 248:603-11.
26. Houeto JL, Mesnage V, Mallet L, Pillon B, Gargiulo M, du Moncel ST, Bonnet AM, Pidoux B, Dormont D, Cornu P, Agid Y. Behavioural disorders, Parkinson's disease and subthalamic stimulation. J Neurol Neurosurg Psychiatry. 2002 Jun; 72(6):701-7.
27. Smeding HM, Speelman JD, Koning-Haanstra M, Schuurman PR, Nijssen P, van Laar T, Schmand B. Neuropsychological effects of bilateral STN stimulation in Parkinson disease: a controlled study. Neurology 2006; 66(12):1830-6.
28. Rothlind JC, Cockshott RW, Starr PA, Marks WJ. Neuropsychological performance following staged bilateral pallidal or subthalamic nucleus deep brain stimulation for Parkinson's disease. J Int Neuropsychol Soc 2007 Jan; 13(1):68-79.
29. Trepanier LL, Kumar R, Lozano AM, Lang AE, Saint-Cyr JA. Neuropsychological outcome of GPi pallidotomy and GPi or STN deep brain stimulation in Parkinson´s disease. Brain and Cognition 2000; 42(3):324-347.
30. Jahanshahi M, Ardouin CM, Brown RG, Rothwell JC, Obeso J, Albanese A et al. The impact of deep brain stimulation on executive function in Parkinson's disease. Brain 2000 Jun; 123(6):1142-54.
31. Ardouin C, Pillon B, Peiffer E, Bejjani P, Limousin P, Damier P et al. Bilateral subthalamic or pallidal stimulation for Parkinson’s disease affects neither memory nor executive functions: a consecutive series of 62 patients. Ann Neurol 1999; 46:217–223.
32. Krack P, Batir A, Van Blercom N, Chabardes S, Fraix V, Ardouin C et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson's disease. N Engl J Med 2003 Nov; 349(20):1925-34.
33. Temel Y, Kessels A, Tan S, Topdag A, Boon P, Visser-Vandewalle V. Behavioural changes after bilateral subthalamic stimulation in advanced Parkinson disease: a systematic review. Parkinsonism Relat Disord 2006 Jun; 12(5):265-72.
34. Grace J, Malloy PF. Frontal Systems Behavior Scale: Professional manual. Lutz, FL: Psychological Assessment Resources; 2001.
35. Grace J, Stout J, Malloy PF. Assessing frontal lobe behavioral syndromes with the Frontal Lobe Personality Scale. Assessment 1999; 6:269-284.
36. Stout JC, Ready RE, Grace J, Malloy PF, Paulsen JS. Factor analysis of the frontal systems behavior scale (FrSBe). Assessment 2003; 10(1):79-85.
37. Goverover Y, Chiaravalloti N, DeLuca J. The relationship between self-awareness of neurobehavioral symptoms, cognitive functioning, and emotional symptoms in multiple sclerosis. J Mult Scler 2005 Apr; 11(2):203-12.
38. Velligan DI, Ritch JL, Sui D, DiCocco M, Huntzinger CD. Frontal Systems Behavior Scale in schizophrenia: relationships with psychiatric symptomatology, cognition and adaptive function. Psychiatry Res 2002 Dec 30; 113(3):227-36.
39. Zawacki TM, Grace J, Paul R, Moser DJ, Ott BR, Gordon N et al. Behavioral Problems as Predictors of functional Abilities of Vascular Dementia Patients. J Neuropsychiatry Clin Neurosci 2002; 14:296-302.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.