Objetivos: Averiguar si existen diferencias en calidad de vida (CV) entre dos grupos de mujeres [con cáncer de mama(CM) y con cáncer ginecológico(CG)] sometidas a cirugía radical, y si tales diferencias se ven influidas por la edad. Adicionalmente, se analiza la relación de variables sociodemográficas y médicas de interés con la CV.
Método: La muestra incluye 100 mujeres (19-83 años), reclutadas según los siguientes criterios: mayores de 18 años, cirugía radical, no estar recibiendo tratamiento antineoplásico (excepto TH), con menopausia, un máximo de dos años desde la finalización del tratamiento y consentimiento informado. La CV se midió con el cuestionario EORTC QLQ-30(1).
Resultados: Se efectuó un ANOVA de dos factores: tipo de cáncer (mama/ginecológico) y edad (menos de 50/ más de 50). El análisis mostró una interacción significativa entre tipo de cáncer y edad en CV emocional, encontrando que el grupo de CM presentaba peor CV que el de CG sólo entre las mujeres mayores de 50 años, pero no entre las jóvenes. Paralelamente, en ambos tipos de cáncer las mujeres mayores obtuvieron mejor puntuación en CV que las jóvenes. Respecto a la CV cognitiva, social y global sólo se detectaron diferencias en función de la edad, en la misma dirección anterior. No hubo diferencias en CV física y de rol. La CV global correlacionaba positiva y significativamente con el número de hijos y la situación laboral, y negativamente con los planes para tener más descendencia y los síntomas postratamiento actuales.
Conclusión: nuestros resultados son coherentes con otras investigaciones(2) y sugieren que la edad juega un papel fundamental en el proceso de adaptación a la enfermedad.
Calidad de vida en mujeres con cáncer de mama y ginecológico.
(Quality of life in women with breast and gynecologic cancer. )
Carmen Bragado Álvarez*; Paloma Gómez Campelo**; Mª José Hernández Lloreda**.
* Dpto. de personalidad, Evaluación y psicología Clínica. Facultad de psicología. UCM
** Dpto. de Metodología de las Ciencias del Comportamiento. Facultad de psicología. UCM.
(KEYWORDS: Quality of life, Breast cancer, Gynecologic cancer. )
Resumen
Objetivos: Averiguar si existen diferencias en calidad de vida (CV) entre dos grupos de mujeres [con cáncer de mama(CM) y con cáncer ginecológico(CG)] sometidas a cirugía radical, y si tales diferencias se ven influidas por la edad. Adicionalmente, se analiza la relación de variables sociodemográficas y médicas de interés con la CV.
Método: La muestra incluye 100 mujeres (19-83 años), reclutadas según los siguientes criterios: mayores de 18 años, cirugía radical, no estar recibiendo tratamiento antineoplásico (excepto TH), con menopausia, un máximo de dos años desde la finalización del tratamiento y consentimiento informado. La CV se midió con el cuestionario EORTC QLQ-30(1).
Resultados: Se efectuó un ANOVA de dos factores: tipo de cáncer (mama/ginecológico) y edad (menos de 50/ más de 50). El análisis mostró una interacción significativa entre tipo de cáncer y edad en CV emocional, encontrando que el grupo de CM presentaba peor CV que el de CG sólo entre las mujeres mayores de 50 años, pero no entre las jóvenes. Paralelamente, en ambos tipos de cáncer las mujeres mayores obtuvieron mejor puntuación en CV que las jóvenes. Respecto a la CV cognitiva, social y global sólo se detectaron diferencias en función de la edad, en la misma dirección anterior. No hubo diferencias en CV física y de rol. La CV global correlacionaba positiva y significativamente con el número de hijos y la situación laboral, y negativamente con los planes para tener más descendencia y los síntomas postratamiento actuales.
Conclusión: nuestros resultados son coherentes con otras investigaciones(2) y sugieren que la edad juega un papel fundamental en el proceso de adaptación a la enfermedad.
Abstract
Objective: To determine whether there are differences in quality of life (QL) in two groups of women [breast cancer (BC) and gynecologic cancer (GC)] who had been through radical surgery, and if such differences are influenced by age. The relationship between sociodemographic and medical variables, and QL, is also examined.
Method: The sample comprises 100 women (19-83 years old), who matched the following criteria: being at least 18 years old, radical surgery, not receiving antineoplastic treatment (except HT), presenting menopause, not having passed more than two years since the end of the treatment and having signed an informed consent. QL was measured by the EORTC QLQ-30 (1).
Results: A two-way ANOVA analysis was used: type of cancer (BC, GC) and age (over/under 50). There was a significant interaction between the type of cancer and age for emotional QL, showing that the GC group had better QL than BC only in the elder women, but not in the younger ones. Likewise, in both types of cancer, the elder women had better QL than the younger ones. Regarding cognitive, social and global QL, the results pointed to the latter conclusion. No differences were found according to the physical and role QL.
Global QL related positive and significantly with the number of children and working situation, and negatively with future offspring plans and present post-treatment symptoms. Conclusion: Overall, our results matched those obtained in other investigations (2), and suggest that age plays an important role in the disease’s adaptation process.
Los avances producidos en los últimos años en el diagnóstico y el tratamiento del cáncer han dado lugar a un notable aumento de la expectativa de vida de las personas aquejadas por esta enfermedad (1, 2), lo que a su vez ha propiciado un interés creciente por incluir la calidad de vida en la valoración del estado de salud de los supervivientes (3). El cáncer y su tratamiento pueden alterar drásticamente la vida de las personas, dado que deben afrontar una serie de cambios, muchas veces irreversibles, que acaban por involucrar a todas las áreas de funcionamiento individual y social, por lo que en la actualidad no se trata sólo de conseguir que el enfermo viva más tiempo sino que lo haga del mejor modo posible.
Por lo que respecta a los dos tipos de cáncer característicos de la mujer, mama y ginecológico, la investigación sobre calidad de vida se ha dirigido primordialmente al primero, probablemente porque es mucho más frecuente que el segundo y quizá también porque la sociedad actual confiere un significado muy especial al pecho femenino. Se estima que alrededor de un tercio de las mujeres con esta patología perciben que su calidad de vida ha empeorado a consecuencia de la enfermedad y su tratamiento. Varios trabajos han investigado si el tipo de tratamiento practicado (conservador/ radical) tiene algún efecto diferencial sobre la calidad de vida; los resultados obtenidos son confusos, mientras algunos indican que las mujeres que han recibido un tratamiento conservador muestran mejor calidad de vida que las sometidas a una mastectomía (4-7), otros no encuentran diferencias entre ellas (8-10). También existen ciertas dudas acerca de que las mujeres mastectomizadas que optan por la reconstrucción se sientan mejor que las que no lo hacen (11).
En comparación con la atención prestada al impacto del cáncer de mama sobre el estado general de salud-calidad de vida de la mujer, pocos trabajos han abordado este tópico en el caso del cáncer ginecológico (3), aunque en los últimos años se observa un aumento en el número de publicaciones sobre esta temática (12-16). En general, los datos indican que las mujeres con cáncer ginecológico experimentan cambios importantes en su vida que afectan a diversas áreas de funcionamiento (actividad sexual, relaciones interpersonales, procreación, etc. ), por lo que suelen valorar su estado general peor que antes de la enfermedad (12, 15), aunque esta situación tiende a remitir con el paso del tiempo, alcanzando un nivel de calidad de vida en algunas dimensiones (física, emocional y estado de salud) equiparable al de la población general (14-15).
Diferentes estudios han analizado si la percepción de la calidad de vida resulta influida por factores sociodemográficos (4-5, 8, 15, 17-18). Los resultados más destacables indican que las mujeres mayores presentan mejor funcionamiento emocional, social y global que las jóvenes, las casadas mejor que las solteras y las que tienen mayor nivel educativo mejor que las que lo tienen más bajo.
Pese a que a día de hoy ya existen numerosos trabajos científicos sobre el impacto vital del cáncer de mama y ginecológico, sorprende que aún no se hayan realizado estudios comparativos que analicen si existe algún efecto diferencial en la calidad de vida de la mujeres que padecen uno u otro. Sobre todo si tiene en cuenta ambos tipos de cáncer afectan a los caracteres sexuales que definen la propia condición femenina.
Precisamente, el objetivo de la presente investigación es averiguar si existen diferencias en calidad de vida entre dos grupos de mujeres aquejadas de cáncer de mama y ginecológico, sometidas a cirugía radical, y si tales diferencias se ven influidas por la edad (mayores o menores de cincuenta años). Adicionalmente, se analiza la relación de variables sociodemográficas y médicas de interés con la calidad de vida. En principio, se espera que debido a la presión social que existe sobre la perfección externa de la figura femenina, las mujeres sometidas a una mastectomía (CM) perciban que tienen una peor calidad de vida (especialmente emocional y social) que las sometidas a una histerectomía/ooforectomía, dado que los cambios provocados por la cirugía pasan menos desapercibidos para los demás en el primer caso que en el segundo. No obstante, pensamos que estas diferencias pueden estar influidas por la edad, por lo que suponemos que, independientemente del tipo cáncer, las mujeres más jóvenes obtendrán peores resultados en calidad de vida que las de mayor edad; igualmente creemos que las diferencias postuladas entre los dos grupos de cáncer serán más evidentes entre las mujeres mayores que entre las jóvenes.
Método
Participantes
En el presente estudio participaron un total de 100 mujeres de 19 - 83 años de edad (media 48, 59 años, DT: 13, 792), 50 con cáncer de mama (CM) y 50 con cáncer ginecológico (CG); todas ellas habían sido intervenidas quirúrgicamente y se les había practicado una mastectomía (CM) o una histerectomía/ooforectomía (CG) para erradicar el tumor.
La muestra fue reclutada en el Centro Oncológico Regional Príncipe de Asturias del hospital General Universitario “Gregorio Marañón” de la Comunidad de Madrid, atendiendo a los siguientes criterios de inclusión: tener más de 18 años, saber leer y escribir, haber sido intervenidas con cirugía radical, no estar recibiendo tratamiento activo contra el cáncer en el momento del estudio (excepto terapia hormonal), presentar menopausia (bien por edad o como consecuencia del tratamiento), que no hubieran transcurrido más de dos años desde que finalizó el tratamiento y firmar un consentimiento informado. Además, se tomaron en consideración algunos criterios de exclusión: no tener nacionalidad española, encontrarse en un estadio terminal de la enfermedad (estadio IV), padecer dos neoplasias de origen primario en distintas localizaciones, haber padecido en el pasado otro cáncer en una localización diferente, sufrir otra patología crónica no oncológica y estar diagnosticadas con alguna alteración neurológica o cognoscitiva que pudiera limitar la capacidad de comprensión.
Instrumentos
Para recoger la información de las variables sociodemográficas y médicas se elaboró un cuestionario biográfico “ad hoc” que cubría los siguientes campos: (a) datos demográficos: edad, estado civil (con o sin pareja), número de hijos o planes para tener más hijos, total de años de educación, situación laboral (en activo/inactiva), tipo de ocupación, nivel socioeconómico (bajo, medio, alto); (b) datos médicos: tipo de cáncer y cirugía, estadio de la enfermedad (I, II, III), tiempo desde el diagnóstico, tratamientos antineoplásicos recibidos además de la cirugía, reconstrucción de la mama, síntomas secundarios durante el tratamiento, síntomas postratamiento actuales – en el momento del estudio - (fatiga, cansancio, debilidad, linfedema, etc. ), síntomas asociados a la menopausia (sofocos, sequedad vaginal, etc. ) y recidiva de la enfermedad.
La calidad de vida se midió con la versión española (19) del EORTC QLQ-C30 (The European Organization for Research and Treatment of Cancer Quality of life core questionnaire, EORTC QLQ-C30) (20). Este cuestionario ha sido creado por la Organización Europea para la Investigación y tratamiento del Cáncer para evaluar el efecto de la enfermedad y sus tratamientos en la calidad de vida de los pacientes oncológicos (20-21); es uno de los instrumentos más utilizados en este campo de estudio. Consta de treinta ítems agrupados en cinco subescalas de funcionamiento vital (físico, emocional, de rol, cognitivo y social), tres escalas de síntomas (fatiga, dolor y náuseas / vómitos), una escala global de salud-calidad de vida y una serie de ítems individuales que miden síntomas adicionales (disnea, insomnio, pérdida de apetito, estreñimiento, diarrea e impacto financiero). La consistencia interna (alpha de Cronbach) obtenida con diferentes grupos de población oscila entre 0, 50 – 0, 86 para la escala global, entre 0, 52 y 0, 85 para las distintas escalas de funcionamiento y entre 0, 65 y 0, 91 para las de síntomas (20, 22). La fiabilidad test-retest es buena, con valores situados entre 0, 82-0, 91 (23). Los estudios realizados con población española arrojan cifras similares para la fiabilidad test-retest (entre 0, 70-0, 91) y algo más elevados para la consistencia interna, entre 0, 79-0, 85 (19, 24-26).
En el presente trabajo se han utilizado las cinco escalas de funcionamiento y la escala global. El funcionamiento físico evalúa la dificultad para realizar ciertas actividades cotidianas y de autocuidado de forma autónoma; el emocional mide síntomas emocionales (nerviosismo, preocupación, irritabilidad, depresión); el de rol alude a los impedimentos encontrados para realizar actividades laborales y de ocio; el cognitivo se centra en las dificultades de concentración y memoria; y el social evalúa la interferencia ocasionada por el estado físico o el tratamiento médico en la vida familiar y las actividades sociales. Por último, la calidad de vida global se refiere a una valoración general de la salud y de la calidad de vida. Los coeficientes de consistencia interna (alfa de Cronbach) hallados en nuestro estudio son: 0, 93 para la escala global y de 0, 71, 0, 94, 0, 81, 0, 85 y 0, 85 para las escalas de funcionamiento físico, emocional, de rol, cognitiva y social, respectivamente.
El EORTC QLQ-C30 combina dos formatos de respuesta: dicotómica (si/no) y tipo Likert, de cuatro (en absoluto, poco, bastante y mucho) y siete puntos (desde pésimo a excelente), para su corrección es preciso realizar una transformación de las puntuaciones a una escala de 0 a 100 puntos; a mayor puntuación mejor calidad de vida, siendo 100 el máximo valor posible.
Procedimiento
El primer paso consintió en solicitar todos los permisos preceptivos para poder realizar el estudio. Una vez aprobado el proyecto y su ejecución, se llevaron a cabo las gestiones encaminadas a reclutar la muestra. Se emplearon dos vías de acceso: a través de los oncólogos del centro y a través de la unidad de psicooncología. En ambos casos se mantuvo una entrevista individual con cada uno de los profesionales involucrados, en la que se explicó detalladamente el propósito de la investigación (objetivos, variables de estudio, instrumentos de evaluación, etc. ), entregando además un dossier con toda la documentación necesaria, en el que se incluía entre otros documentos un impreso informativo para las posibles participantes.
Respecto a la primera vía, cuando las pacientes acudían a revisión, el médico identificaba las que cumplían los criterios de selección y les planteaba la posibilidad de participar en el estudio; en el supuesto de sentirse motivadas, se les entregaba un impreso para que pudieran solicitar una cita. Las interesadas se ponían en contacto con la Unidad de Psico-oncología (personal o telefónicamente), donde se les indicaba el día y hora de la entrevista con la investigadora responsable de recoger la muestra. A fin de facilitar el proceso, se procuró que la cita coincidiera con alguna otra consulta programada en el hospital. Antes de comenzar la evaluación se dedicaban unos minutos a explicar en qué consistía el estudio, a fin de solventar posibles dudas. Posteriormente, se les entregaba el consentimiento informado para que lo leyeran y firmaran, y, una vez formalizado este trámite, se procedía a la evaluación propiamente dicha, comenzando por el cuestionario biográfico, seguido del de calidad de vida.
El acceso a las pacientes a través de la segunda vía se realizó de dos formas: en primer lugar, se identificó a las que se encontraban en tratamiento psicológico en ese momento y se ajustaban a los criterios de participación; en segundo lugar, se revisaron los archivos de la unidad, seleccionando a las que cumplían los requisitos exigidos. En los dos casos, se entabló contacto telefónico con las posibles candidatas, explicándoles en que consistía el estudio y animándolas colaborar, concertando una cita en consulta. Por lo demás, el procedimiento fue exactamente igual que el utilizado en la primera vía de acceso.
A todas las participantes se les brindó la oportunidad de conocer el resultado de su evaluación y de solicitar tratamiento psicológico si lo necesitaban. La asignación al grupo correspondiente (CM mayores de 50 años, CM con menos de 50, CG mayores de 50 y CG con menos de 50) se realizó al término de cada evaluación individual. El proceso de recogida se dio por concluido cuando se alcanzó el número suficiente en cada grupo (25 pacientes). El tiempo invertido en el reclutamiento de la muestra fue de 18 meses.
Análisis de datos
Para comprobar si había diferencias entre grupos en las variables objeto de estudio, se llevó a cabo un ANOVA de dos factores: tipo de cáncer (mama/ ginecológico) y edad (menos de 50 años / más de 50) para cada una de las variables cuantitativas y la prueba de independencia de Ji-cuadrado de Pearson y la V de Cramer para las cualitativas. En todos los ANOVAs se comprobaron los supuestos de normalidad e igualdad de varianzas; en el caso de que no se cumplieran, se realizó una transformación de la variable y, si por este procedimiento tampoco se lograba su cumplimiento, se procedió a utilizar una prueba no paramétrica, en particular, la de Kruskal-Wallis para k muestras independientes. Por último, para atender al segundo objetivo del trabajo, se realizó un análisis correlacional entre las variables sociodemográficas y médicas con la escala de calidad de vida global. Todos los análisis se efectuaron con el SPSS para Windows (versión 12. 00).
Resultados
En general, los grupos resultaron bastante homogéneos en las siguientes variables: estado civil, situación laboral, nivel socioeconómico, estadio de la enfermedad, tratamientos oncológicos adyuvantes, síntomas postratamiento actuales, síntomas asociados a la menopausia y recidiva de la enfermedad (véanse tablas 1 y 2). Se encontraron algunas diferencias que reflejaban características intrínsecas a la propia composición del grupo, a saber: las mujeres menores de 50 años tenían menos hijos, más años de educación y mostraban una tendencia mayor a trabajar por cuenta ajena o con profesiones asociadas a titulación universitaria que las mayores de 50; en la misma línea, las mujeres con CM de menos de 50 años mostraban una tendencia mayor a reconstruirse la mama que las de mayor edad.
No obstante, también se apreciaron diferencias en dos variables, tiempo desde el diagnóstico y síntomas secundarios al tratamiento, que podían oscurecer los resultados en calidad de vida. Respecto a la primera, el tiempo transcurrido desde el diagnóstico fue superior entre las mujeres mayores de 50 años que entre las de menos de 50 (16, 8 meses vs. 13, 28, respectivamente), aunque no se detectaron diferencias en función del tipo de cáncer (F1, 96=0, 59, p=0, 44, 1-ß=0, 12) ni de la interacción tipo de cáncer/edad (F1, 96= 0, 95, p=0, 33, 1-ß=0, 16). En cuanto a la segunda, el grupo de CM había experimentado significativamente menos síntomas durante el tratamiento que el grupo de CG (8, 1 vs. 9, 7, respectivamente), pero el tamaño del efecto en este caso fue bajo (n2= 0, 04).
Tabla 1. Descriptivos y diferencias entre grupos en las variables sociodemográficas
NOTA: CM: cáncer de mama; CG: cáncer ginecológico. <50, >50 menos y más de 50 años, respectivamente. En negrita diferencias estadísticamente significativas (p<0, 05). 1-ß= potencia de contraste, F1: tipo de cáncer; F2: edad; F3: interacción (tipo cáncer / edad); n2: eta al cuadrado parcial (tamaño del efecto); V: V de Cramer.
Tabla 2. Descriptivos y diferencias entre grupos en las variables médicas
NOTA. CM: cáncer de mama; CG: cáncer ginecológico; <50, >50: menos y más de 50 años, respectivamente. En negrita los análisis estadísticamente significativos (p < 0, 05. ). 1-ß= potencia de contraste, F1: tipo de cáncer; F2: edad; F3: interacción (tipo de cáncer * edad); n2: eta al cuadrado parcial (tamaño del efecto); V: V de Cramer. Cx: cirugía;
Por lo que respecta a la calidad de vida (CV), los análisis indicaron que no había diferencias entre grupos en las escalas de funcionamiento físico y de rol. En la CV emocional se encontraron efectos estadísticamente significativos del tipo de cáncer, la edad y la interacción entre ambos factores (tabla 3). Los resultados mostraron que las mujeres con CM tenían peor funcionamiento emocional que las CG (X= 44, 6 vs. 59, respectivamente), las mayores de 50 años mejor que las jóvenes (X= 75, 66 vs. 28, respectivamente) y que existía interacción entre ambas variables (F1, 96 = 6, 77; p=0, 01). Las diferencias relativas a la edad fueron más claras que las halladas entre ambos tipos de cáncer, dado que el tamaño del efecto fue más elevado en el primer caso que en el segundo (n2 = 0, 44 vs. 0, 07, respectivamente); el tamaño del efecto de la interacción tipo de cáncer / edad también fue discreto (n2 = 0, 07). No obstante y en la línea de lo esperado, las comparaciones post hoc (Bonferroni) señalaron que las pacientes con CM mayores de 50 años mostraban peor funcionamiento emocional que las de CG del mismo grupo de edad (X= 61, 33 vs. 90, respectivamente), pero estas diferencias no se mantenían entre las menores de cincuenta, que presentaban idéntica puntuación (X= 28 vs. 28, CM y CG, respectivamente).
En cuanto al funcionamiento social, al no cumplirse los supuestos de normalidad e igualdad de varianzas se empleó el análisis de Kruskal-Wallis, que indicó que había diferencias entre los grupos objeto de comparación (Kruskal-Wallis3 = 29, 653, p<0, 000). Las comparaciones múltiples entre ellos (prueba de Mann-Whitney) mostraron que en general las mujeres mayores de 50 años presentaban mejor CV social que las jóvenes (U de Mann-Whitney = 101, p<0, 000). Por otro lado, se apreció cierta tendencia a la interacción entre tipo cáncer y edad, dado que al comparar los dos tipos de cáncer entre las mujeres de más de 50 años, las del grupo de CM tenían peor calidad que las del grupo de CG (U de Mann-Whitney = 196, 5, p<0, 005), pero esto no sucedía entre las jóvenes (U de Mann-Whitney= 306, p= 0, 897), ni al comparar ambos tipos de cáncer sin considerar la edad (U de Mann-Whitney=1086, p=0, 229).
En el resto de las escalas, funcionamiento cognitivo y CV global, sólo se detectaron diferencias significativas en función de la edad, siempre en la misma dirección anterior: las mujeres de más edad mostraban mejor calidad de vida que las jóvenes, independientemente del tipo de cáncer (véase tabla 3). Sin embargo, conviene recalcar que en las dos escalas la interacción entre tipo de cáncer y edad se encuentra próxima al nivel de significación estadística (F1, 96 = 3, 58, p<0, 06; F1, 96= 3, 278, p<0, 07, respectivamente), aunque el tamaño del efecto en ambos casos es pequeño (n2= 0, 04 y 0, 03, respectivamente). Debido a esta proximidad a la significación, se efectuaron las correspondientes comparaciones post hoc (Bonferroni), cuyos resultados confirmaron la ausencia de diferencias en CV cognitiva entre las mujeres con CM y CG en los dos niveles de edad. Pero en CV global mostraron que las pacientes con CM mayores de 50 años tenían peor puntuación que las de CG del mismo grupo de edad (X= 68, 33 vs. 82, 66, respectivamente; F1, 96= 4, 483, p<0, 04).
Por último, los resultados del análisis correlacional indicaron que la CV global correlacionaba positiva y significativamente con el número de hijos y encontrase en una situación laboral activa, y negativamente con la edad, los planes para tener más descendencia y los síntomas postratamiento actuales (véase tabla 4). Lo que sugiere que las mujeres de más edad, con mayor número de hijos, laboralmente activas y que tienen pocos síntomas postratamiento valoran mejor su CV global que las que no reúnen este perfil. Ni el tipo de cáncer, ni el tiempo desde el diagnóstico, ni el estadio de la enfermedad o la reconstrucción de la mama mostraron una asociación significativa con la calidad de vida global (tabla 4).
Tabla 3. Diferencias en calidad de vida- EORTC-QLQ C30
NOTA. CM: cáncer de mama; CG: cáncer ginecológico; CV: calidad de vida; en negrita los análisis estadísticamente significativos (p<0, 05). F1: tipo de cáncer; F2: edad; F3: interacción (tipo de cáncer * edad); n2: eta al cuadrado parcial (tamaño del efecto); 1-ß: potencia de contraste; V: V de Cramer.
Gráfico 1. Resultados en calidad de vida (medias)
Tabla 4. Correlaciones entre las variables sociodemográficas y médicas y CV global
NOTA: * p< 0, 05 (bilateral); ** p< 0, 01 (bilateral); las variables cualitativas han sido codificadas como variables Dummy, donde 0 es la primera categoría que aparece entre paréntesis; (a): correlación de Spearman.
Discusión y conclusiones
El objetivo fundamental de esta investigación era averiguar si existían diferencias en calidad de vida entre mujeres con CM y CG, sometidas cirugía radical (mastectomía, histerectomía/ ooforectomía), y si la edad tiene alguna influencia sobre esta variable. En relación con este objetivo, se anticipaba que, debido a la gran importancia que se concede en nuestra cultura a un cuerpo exteriormente perfecto, las mujeres mastectomizadas valorarían peor su CV que las histerectomizadas/ ooforectomizadas, especialmente en lo relativo al funcionamiento emocional y social, aunque tales diferencias estarían matizadas por la edad. En este sentido, se esperaba que sólo hubiera diferencias entre ambos tipos de cáncer en las mujeres mayores de 50 años, donde el grupo con CM presentaría peores resultados que el de CG, y que no las hubiera entre las mujeres con menos de cincuenta.
Nuestros resultados ponen de manifiesto que la edad juega un papel fundamental en la percepción de la calidad de vida. En general, las mujeres con más de cincuenta años valoran mejor su calidad de vida que las jóvenes en casi todas las áreas de funcionamiento vital (emocional, cognitiva y social) y en CV global. No obstante y acorde con nuestras predicciones, entre las de mayor edad se aprecian diferencias en función del tipo cáncer en CV emocional y social a favor de las mujeres con CG, que obtienen puntuaciones más elevadas en estas escalas que las de CM, observándose una tendencia similar en la CV global, lo que lleva a pensar que en este rango de edad la pérdida de la mama se vive de forma más negativa que la de los órganos reproductores. Dado que no hemos encontrado otros trabajos similares al nuestro, no es posible realizar una valoración comparativa de los datos.
Continuando con la edad, nuestros resultados son consistentes con los hallados en otros trabajos que han investigado el efecto de esta variable en la CV de mujeres aquejadas de cáncer de mama o ginecológico, en los que también se encontró que las más jóvenes mostraban más dificultades que las mayores en el funcionamiento emocional, cognitivo, social/ familiar y evaluaban peor que ellas su estado general y calidad de vida global (15, 17-18). En cierta medida, estos hallazgos no hacen más que reflejar una realidad diferente entre unas y otras, sobre todo si se tiene en cuenta que las demandas de adaptación a la nueva situación son más elevadas para las mujeres jóvenes, puesto que tienen que asumir de golpe una serie de cambios que afectan seriamente a su ciclo vital (pérdida de la capacidad reproductiva, modificación de la imagen corporal, pérdida de identidad); cambios que no sólo interrumpen su vida presente (estudios, actividad laboral, relaciones de pareja, etc. ) sino que ponen en peligro sus proyectos de futuro (tener hijos propios. . ), lo que implica que experimenten más distrés emocional y valoren peor su calidad de vida. Por otro lado, parece que el modo de entender el bienestar físico, psicológico y social varía con la edad y que, comparadas con las jóvenes, las mujeres mayores otorgan menos importancia a los cambios provocados por la enfermedad y su tratamiento, tal vez porque ya han cubierto muchas de sus expectativas vitales, lo que se traduce en una mejor percepción de su calidad de vida actual (5, 14-15). En apoyo de estas ideas, nuestros datos señalan que tener más edad, encontrase en una situación laboralmente activa y el número de hijos se relacionan con una mejor valoración del estado de salud y de la CV global, mientras los planes para tener hijos en el futuro lo hace negativamente.
A diferencia de otros trabajos (5, 15), en éste no se han encontrado diferencias en el funcionamiento físico y de rol, ni en función de la edad, ni por el tipo de cáncer. Los cuatro grupos de comparación mostraban un buen funcionamiento en estos dos ámbitos (todas las puntuaciones superaban los 70 puntos), lo que sugiere que las secuelas físicas del tratamiento y la cirugía ya habían remitido y las pacientes no tenían demasiada dificultad para llevar a cabo sus actividades cotidianas. De hecho, todos los grupos presentaban un número bajo de síntomas postratamiento (menos de 4 sobre un total de 20 posibles) sin diferencias significativas entre ellos. Al respecto, se ha señalado que la mayoría de las mujeres muestran un funcionamiento equiparable a las de la población general de la misma edad a los 6 - 12 meses posteriores al tratamiento (5, 15, 27). En nuestro trabajo desconocemos el tiempo transcurrido desde la finalización del tratamiento, dado que no hemos considerado esta variable, aunque sí sabemos que ya lo habían concluido y que no había transcurrido un periodo superior a dos años desde su finalización, ya que este fue uno de los requisitos para participar en el estudio.
A excepción de los síntomas actuales postratamiento, ninguna otra variable médica de las consideradas resultó relacionada con la calidad de vida global. En este sentido, llama la atención la ausencia de relación (estadísticamente significativa) entre la reconstrucción de la mama y la CV, dado que cabría esperar que las mujeres que se han reconstruido se encontraran más satisfechas con su vida que las que no lo han hecho. Los estudios previos presentan resultados confusos acerca del efecto de la reconstrucción en la CV, entendida en sentido amplio; mientras algunos apuntan a que las mujeres que se reconstruyen la mama se encuentran psicológicamente mejor que las que no lo han hecho (28-29), otros (11) han indicado justamente lo contrario, que las mujeres sometidas a cirugía reconstructora se sienten peor física, emocionalmente y en el funcionamiento general que las no reconstruidas. Se ha sugerido que esto puede ser debido a que las mujeres que optan por la reconstrucción deben enfrentarse a nuevas fuentes de estrés (intervenciones quirúrgicas, hospitalizaciones, postoperatorios dolorosos y restricción de las actividades cotidianas) que no afectan a las no reconstruidas (11), aunque seguramente también entren en juego otros factores no contemplados en estos trabajos ni en el nuestro, como el grado de satisfacción personal con el resultado obtenido.
Para finalizar, señalar al menos dos limitaciones de esta investigación que habrán de tomarse en consideración al valorar los resultados. En primer lugar, los datos obtenidos provienen de una muestra incidental, lo que dificulta la generalización de los resultados a la población general de pacientes con la misma patología. Y en segundo lugar, no se han considerado algunas variables que podrían estar influyendo en los resultados, como son el tiempo desde la finalización del tratamiento médico o el tiempo transcurrido desde la reconstrucción mamaria, por lo que desconocemos el efecto del paso del tiempo en la CV. Por otro lado, creemos que nuestros resultados tendrían más peso si se hubieran podido comparar con los obtenidos por un grupo de control de mujeres sanas procedentes de la población general. Con todo, pensamos que el verdadero interés de este trabajo radica en que se compara la calidad de vida de las mujeres sometidas a cirugía radical en dos tipos de cáncer propios de la condición femenina, algo que salvo desconocimiento nuestro aún no se ha hecho; incluye una muestra de un tamaño más que aceptable, comparado con los que se observan en la bibliografía especializada y aporta resultados sugerentes que abren nuevas vías de investigación. Entre ellos, que la CV resulta más afectada en las mujeres con CM que rebasan la barrera de los 50 años que en las de CG del mismo rango de edad y que el hecho de reconstruirse la mama perdida no se asocia con una mejor percepción de la CV global.
Referencias bibliográficas
1. López-Abente G, Pollán M, Aragonés N, Pérez-Gómez B. Informe sobre la salud de los españoles. Cáncer. Centro Nacional de epidemiología. Citado 20 Oct 2007. Disponible en: URL:www. 193. 146. 50. 130/cancer/salud-cancer. pdf
2. Wright EP, Kiely MA, Lynch P, Cull A, Selby PJ. Social Problems in oncology. Br J Cancer 2002; 87:1099-104.
3. Pilkington FB, Mitchell GJ. Quality of life for women living with a gynecologic cancer. Nurs Sci Q 2004; 17(2); 147-155.
4. Curran D, Van Dongen JP, Aaronson NK, Kiebert G, Fentiman IS, Mignolet F et al. Quality of life of early-stage breast cancer patients treated with radical mastectomy or breast-conserving procedures: Results of EORTC trial 10801. Eur J Cancer 1998; 34: 307-14.
5. King MT, Kenny P, Shiell A, Hall J, Boyages J. Quality of life three months and one year after first treatment for early stage breast cancer: Influence of treatment and patient characteristics. Qual Life Res 2001; 9:789-00.
6. Moyer A. Psychosocial Outcomes of Breast-Conserving Surgery versus Mastectomy: A meta-analytic review. Health Psychol 1997; 16 (3):284-98.
7. Schover LR, Yetman RJ, Tuason LJ, Meisler E, Esselstyn CB, Hermann RE et al. Partial mastectomy and breast reconstruction: a comparison of their effects of psychosocial adjustment, body image, and sexuality. Cancer 1995; 75: 54-64.
8. De Haes JCJM, Curran D, Aaronson WK, Fentiman IS, EORTC. Quality of life in breast cancer patients aged over 70 years, participing in the EORTC 10850 randomised clinical trial. Eur J Cancer 2003; 39(7), 945-51.
9. Ganz PA, Schag CA, Lee JJ, Polinsky ML, Tan S. Breast Conservation versus mastectomy: Is there a difference in psychological adjustment or quality of life in the year after surgery. Cancer 1992; 69: 1729-38.
10. van der Steeg AFW, De Vries J, Roukeman JA. The value of quality of life and health status measurements in the evaluation of the well-being of breast cancer survivors. Eur J Surg Oncol 2007; en prensa.
11. Nissen MJ Swenson KK, Ritz LJ, Farrell JB, Sladek ML, Lally RM. Quality of life after breast carcinoma surgery. A comparison of three surgical procedures. Cancer 2001; 91:1238-46.
12. Ahlberg K, Ekman T, Wallgren A, Gaston-Johansson F. Fatigue, Psychological distress, coping and quality of life in patients with uterine cancer. J Adv Nurs 2004; 45(2):205-13.
13. Guidozzi F. Living with ovarian cancer. Gynecol Oncol 1993; 50:202-7.
14. Chan YM, Ngan YS, Li BY, Yip AM, Ng TY, Lee PW et al. A longitudinal study on quality of life after gynecologic cancer treatment. Gynecol Oncol 2001; 83:10-9.
15. Miller BE, Pittman B, Case D, McQuellon RP. Quality of life after treatment for gynecologic malignancies: a pilot study in an outpatient clinic. Gynecol Oncol 2002; 87:178-84.
16. Wenzel LB, DeAlba I, Habbal R, Coffey B, Fairclough D, Krebs LU et al. Quality of life in long-term cervical cancer survivors. Gynecol Oncol 2005; 97:310-17.
17. Avis NE, Crawford S, Manuel J. Psychosocial problems among younger women with breast cancer. Psycho-oncology 2004; 13:295-308.
18. Bloom JR, Stewart SL, Chang S, Banks PJ. Then and now: quality of life of young breast cancer survivors. Psycho-oncology 2004; 13:147-60.
19. Arraras JI, Illarramendi JJ, Valerdi JJ. El cuestionario de calidad de vida para cáncer de la EORTC, QLQ-C30. Estudio estadístico de validación con una muestra española. Revista de psicología de la Salud 1995; 7(1):13-33.
20. Aaronson NK, Ahmedzai S, Bergman B, Bullinger M, Cull A, Duez NJ et al. The European Organization for Research and Treatment of cancer QLQ-C30: A quality of life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85(5):365-76.
21. Agra Y, Badía, X. Spanish version of the Rotterdam symptom check list: cross cultural adaptation and preliminary validity in a sample of terminal cancer patients. Psycho-oncology 1998; 7: 229-39.
22. Cull AM, Howat S, Greimel E, Waldenstrom AC, Arraras JI, Kudelka A et al. Development of a European Organization for Research and Treatment of Cancer questionnaire module to assess the quality of life of ovarian cancer patients in clinical trials: A progress report. Eur J Cancer 2001; 37(1):47-53.
23. Jensen M, Fossa S, Bjordal K, Kaasa S. Test/Restest study of the European Organization for Research and treatment of cancer core quality of life questionnaire. J Clin Oncol 1995; 13(5):1249-54.
24. Arraras JI. Calidad de vida en el cáncer de pulmón y de mama según la organización europea par la investigación y tratamiento del cáncer-EORTC. Huarte de San Juan psicología y Pedagogía 1999; 4-5:219-37.
25. Arraras JI, Garrido E, Pruja E, Marcos M, Tejedor M, Arias F. El cuestionario de calidad de vida de la EORTC QLQ-C30 (versión 2. 0). Estudio psicométrico con pacientes con cáncer de mama. Clínica y Salud 2000; 11(3):329-49.
26. Godoy MJ. La calidad de vida en pacientes oncológicos. Almería: Universidad de Almería; 2000.
27. Wronska I. The quality of life of women’s life after mastectomy in Poland. Health Care Women International 2003; 24(10):900-9.
28. Al-Ghazal SK, Fallowfield L, Blamey RW. Comparison of psychological aspects and patient satisfaction following breast conserving surgery, simple mastectomy and breast reconstruction. Eur J Cancer 2000; 36:1938-43.
29. Nano MT, Gill PG, Kollias J, Bochner MA, Malycha P, Winefield HR. Psychological impact and cosmetic outcome of surgical breast cancer strategies. ANZ J Surg 2005; 75:940-7.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.





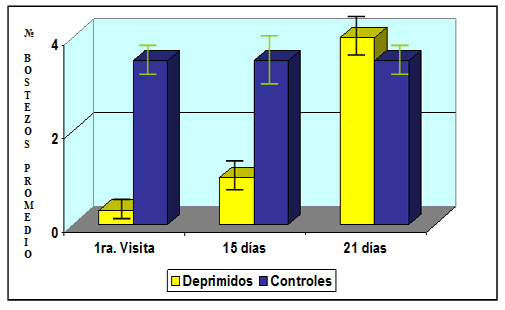

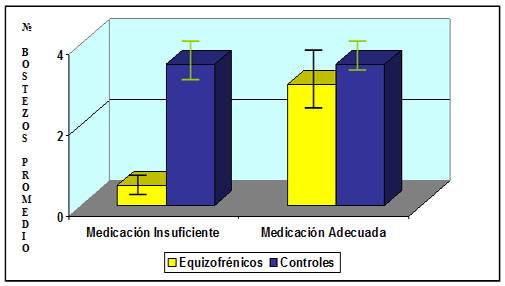
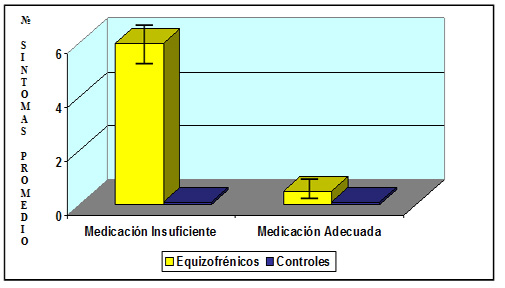
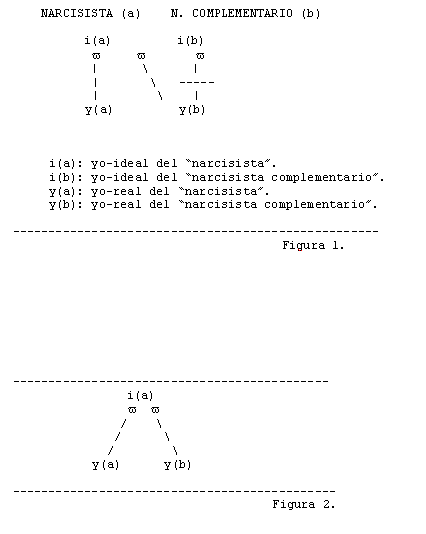



Hormonoterapia y Trastornos del Humor.
Diego Lara barboza et. al
Fecha Publicación: 18/05/2025
Evaluación neuropsicológica en supervivientes de cáncer mama: identificación de necesidades para un enfoque integral en la calidad de vida
Marta Aliño Costa et. al
Fecha Publicación: 18/05/2025
Función terapéutica de las metáforas en el tratamiento del paciente oncológico
CARLA GALINDEZ SIMONATTI et. al
Fecha Publicación: 20/05/2024
Retraso en el diagnóstico de cáncer de mama y colorrectal en personas con trastornos mentales graves.
Pedro Céspedes Aleixandre et. al
Fecha Publicación: 02/05/2019
Título: Necesidad de una intervención de cuidados integrales para mejorar la calidad de vida de las mujeres con cáncer de mama desde el abordaje de la enfermera de Salud Mental.
Tamara del Pino Medina Dorta et. al
Fecha Publicación: 19/02/2019
Ansiedad, racionalidad, armonía y optimismo en el cáncer de mama: un estudio comparativo.
Antonio Cano Vindel et. al
Fecha Publicación: 15/07/2010