El término respuesta de estrés o reacción de alarma se refiere a la respuesta inespecífica del organismo ante cualquier demanda de cambio y se manifiesta a través de la denominada "reacción de fase aguda". Esta reacción incluye una serie de cambios hormonales, inmunes y de otros sistemas que enlazan con los conocimientos actuales acerca de la neurobiología de los circuitos de la emoción a través de la activación de la amígdala, y posteriormente del área paraventricular del hipotálamo.
La expresión periférica de esta reacción se puede estudiar mediante los reactantes de fase aguda. En este trabajo se han estudiado ciertos reactantes de fase aguda en pacientes con trastorno de Angustia respecto a controles sanos y se ha determinado su evolución tras 8 semanas de tratamiento farmacológico, demostrando la existencia de una reacción de este tipo que tiende a remitir con el tratamiento y que en sus valores iniciales puede predecir la respuesta a este tratamiento.
El modelo de reacción de estrés en el trastorno de Angustia.
(Stress response as a model in panic disorder. )
Andrés Herrán*; Maria Teresa García-Unzueta**; Deirdre Sierra Biddle*; María Carrera*; Ana Ayestarán*; José Antonio Amado**.
Programa de Trastornos de Angustia.
Servicios de Psiquiatría* y Endocrinología**. hospital Universitario Marqués de Valdecilla.
Universidad de Cantabria
Santander.
PALABRAS CLAVE: trastorno de angustia, Respuesta de estrés, Reactantes de fase aguda.
(KEYWORDS: Panic disorder, Stress response, Acute phase reagents. )
página 1
[5/2/2003]
Resumen
El término respuesta de estrés o reacción de alarma se refiere a la respuesta inespecífica del organismo ante cualquier demanda de cambio y se manifiesta a través de la denominada "reacción de fase aguda". Esta reacción incluye una serie de cambios hormonales, inmunes y de otros sistemas que enlazan con los conocimientos actuales acerca de la neurobiología de los circuitos de la emoción a través de la activación de la amígdala, y posteriormente del área paraventricular del hipotálamo. La expresión periférica de esta reacción se puede estudiar mediante los reactantes de fase aguda. En este trabajo se han estudiado ciertos reactantes de fase aguda en pacientes con trastorno de Angustia respecto a controles sanos y se ha determinado su evolución tras 8 semanas de tratamiento farmacológico, demostrando la existencia de una reacción de este tipo que tiende a remitir con el tratamiento y que en sus valores iniciales puede predecir la respuesta a este tratamiento.
Abstract
The stress response is the consequence of any demand of change, and is manifested as the so-called acute phase response. This response includes changes in hormonal, and immune systems, related with the "fear circuit" by amigdala and the periventricular hypothalamic areas. The peripheral manifestations of this response are the "acute phase reagents". Here, we have studied some acute phase reagents in a sample of panic disorder patients, compared them with those on healthy subjects and analysed its changes after 8 week follow-up on pharmacological treatment. We have shown that in early phases of panic disorder, patients present an acute phase response, that this response tend to diminish after successful treatment, and could be used to predict the degree of treatment response.
Como se ha comentado en la presentación de esta mesa y como es bien conocido, en la génesis del trastorno de Angustia intervienen varios factores, entre ellos factores genéticos y otros factores biológicos, además de los “determinantes psicosociales” (estilos cognitivos, acontecimientos vitales, etc. ). De entre los factores biológicos en los últimos años se ha despertado un interés creciente en la denominada respuesta de estrés como base para la comprensión de fenómenos que tienen lugar en diversos trastornos mentales. El estudio de este sistema de respuesta se ha desarrollado fundamentalmente en investigación básica (modelos murinos de ansiedad, etc. ) y complementa y se relaciona con la investigación realizada también a este nivel sobre la “circuitería” de la ansiedad (modelos neurobiológicos del miedo).
La respuesta de estrés
El término respuesta de estrés o reacción de alarma fue descrito por Seyle para denominar la respuesta inespecífica del organismo ante cualquier demanda de cambio y se considera un mecanismo fundamental para el conocimiento de la neurobiología de los trastornos de ansiedad. Frente a un agente estresante, el patrón de respuesta típica en los vertebrados se inicia con una primera fase en la que se produce la liberación de la la hormona liberadora de corticotropina en la circulación portal, el aumento en la secreción de catecolaminas, y posteriormente aumento de ACTH, disminución de GnRH, y secreción de prolactina, GH y glucagón. En una segunda fase se estimula la liberación de glucocorticoides y se inhibe la de esteroides sexuales (Sapolsky et al, 2000)
La hormona liberadora de corticotropina hipotalámica (también llamada corticoliberina o CRH) es un polipéptido de 41 aminoácidos considerado como el iniciador de la respuesta de estrés. Se forma en neuronas localizadas en el núcleo paraventricular del hipotálamo y en la región preóptica-hipotálamo anterior.
Estas células se proyectan y vierten la CRH en la región de la eminencia media, desde donde, por el sistema porta, llega a la hipófisis anterior. La CRH activa la secreción de ACTH y otros productos derivados de la proopiomelanocortina en las células hipofisarias a través de la estimulación de receptores de membrana. Estos receptores CRH se encuentran también en otras regiones del cerebro, del sistema simpático e, incluso, de la médula suprarrenal. Así, estimula la actividad simpática provocando hiperglucemia, aumento del consumo de O2 y aumento del gasto cardíaco, estimula la actividad respiratoria y provoca cambios en la conducta, estimulando la actividad de vigilia y alerta (Amado y Flórez, 1997).
Recientemente se ha introducido el término de sistema de la CRH. Esto hace referencia al hecho de que en este sistema participan varios ligandos y varios receptores, y además se encuentran implicadas otras hormonas con efectos estimuladores e inhibidores (Stecker y Holsboer, 1999). El CRH y otra hormona relacionada, la urocortina, se fijan a 2 receptores ligados a proteínas G, el CRHR1 y el CRHR2. Utilizando ratones knock-out se ha encontrado que aquellos carentes del receptor 2 muestran una conducta de ansiedad incrementada además de una alteración en la función cardiovascular, cosa que no pasa con los que carecen del receptor 1, lo que sugiere una actividad ansiolítica para la acción de este receptor (Kishimoto et al, 2000). Por otra parte, a los ratones a los que les falta el CRHR1 muestran una ansiedad reducida. Se ha demostrado que mientras el CRH parece ser el ligando natural por el CRHR1, la urocortina sería el ligando para el CRHR2. Ya se dispone de resultados en primates donde la administración de antagonistas de CRF atenúan las respuestas neuroendocrinas, autonómicas y conductuales al estrés (Habib et al, 2000).
Este sistema de la CRH es considerado el iniciador de la respuesta de estrés, y de su equivalente en términos farmacológicos, la denominada reacción de fase aguda. También de forma precoz en el desarrollo de esta reacción intervienen ciertas citocinas, como la Interleukina-6 (IL-6), la Interleukina-10 y el factor de necrosis tumoral (TNF). Estos mediadores se interrelacionan entre sí en complicados mecanismos de feedback e inician la secuencia de acontecimientos que constituyen la reacción de fase aguda.
Ésta es la respuesta del organismo a diversas condiciones que suponen un insulto para la homeostasis –fundamentalmente la inflamación, pero también enfermedades agudas o factores psicológicos-, y se expresa a través de varios fenómenos de fase aguda, como cambios hormonales (antes descritos) pero también hematopoyéticos, metabólicos o hepáticos. Éstos últimos se manifiestan de forma periférica en forma de los denominados reactantes de fase aguda o proteínas de fase aguda.
Existen reactantes de fase aguda positivos (aquellos cuya concentración aumenta al menos un 25% tras la inflamación) como la proteína C reactiva, las alfa globulinas, el fibrinógeno, etc. Y reactantes de fase aguda negativos (aquellos que descienden) como la albúmina o las gamma globulinas (Whicher 1990). Los reactantes de fase aguda, al ser la expresión periférica de esta secuencia de acontecimientos, pueden ser utilizados como medida indirecta de los acontecimientos que suceden a nivel central, ya que por razones evidentes, la determinación de CRH u otros componentes iniciales (citocinas, etc. ) en el cerebro de humanos no es posible.
La respuesta de estrés y su papel en humanos
El sistema del CRH ha sido implicado en la patogenia del TA, con concentraciones elevadas de CRH en el líquido cefalorraquídeo, “hipersupresión” tras la administración de dexametasona y número aumentado de receptores para glucocorticoides (Boyer, 2000). Los estudios iniciales en el campo de las enfermedades mentales se han realizado en la depresión, donde, como es conocido, la activación del eje hipotálamo-hipófiso-suprarenal es manifiesta y coocida hace tiempo. De hecho, se ha considerado en los últimos años que una diferencia fundamental en las diferencias respecto a la etiopatogenia de la depresión y el TA consistían en que mientras que en la depresión había una alteraión de este eje (supresión tras la administración de dexomatasona, etc. ), ésta no existía en el TA. Sin embargo, hallazgos recientes apuntan hacia una alteración en este sistema también en pacientes con TA.
En efecto, la aparente falta de respuesta del eje hipotálamo hipófiso suprarrenal (hipercortisolemia, etc. ) encontrada en pacientes con TA se ha atribuido a la liberación del péptido atrial natriurético (ANP). Tras las crisis de pánico inducidas experimentalmente por lactato, se produce una secreción pronunciada de ANP, lo que se ha considerado el origen de la falta de respuesta CRH>ACTH>Cortisol que sucede en el pánico (Kellner et al, 1985), ya que el ANP inhibe la liberación de ACTH por CRH (Fink et al, 1991; Guild & Cramb, 1999) y que también puede atenuar la respuesta simpática cardiaca al pánico (Kellner at al, 1998). Además, el tratamiento con ANP disminuye la probabilidad de tener una ataque inducido por lactato y su intensidad (Strohle et al, 2001).
La respuesta de estrés como parte de la "respuesta del miedo"
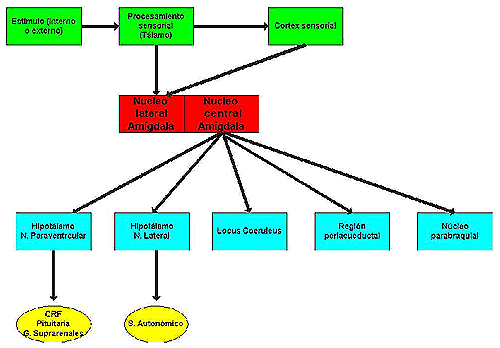
Pero nos podemos preguntar ¿cómo enlazan los hallazgos clínicos en pacientes con TA u otros trastornos de ansiedad con el sistema de estrés? En la Figura 1 se representa e forma esquemática la secuencia de acontecimientos desde la representación mental de un acontecimiento (LeDoux 2000; Gorman et al, 2000).
Figura 1
Tras la generación de un estímulo (externo o “real” o bien interno o “mental”) y ser procesado en el tálamo, la información pasaría al cortex sensorial donde sería reconocido conscientemente como tal, y de aquí a la amígdala, lugar en el supuestamente se produciría la emoción (en este caso el miedo). Sin embargo, datos de experimentación animal sugieren la existencia de una ruta directa desde el tálamo a la amígdala, de forma que al estímulo puede “dar lugar a una emoción” aún sin el reconocimiento consciente de esta asociación estímulo-respuesta emocional (al no intervenir el cortex sensorial). Una vez en la amígdala, la emoción “pasaría” a varias zonas, a través de las cuales se producirían varias respuestas que de forma típica aparecen en el hombre (y otros animales) al experimentar esta emoción. Así, la estimulación del núcleo Parabraquial sería el responsable del aumento de la frecuencia respiratoria, la región gris periacueductal produciría el “freezing” o inhibición, el locus coeruleous seria el responsable por ejemplo del aumento de vigilancia y el hipotálamo lateral del aumento de las manifestaciones adrenérgicas (taquicardia, midirasis, etc. ). La activación del núcleo paraventricular del hipotálamo sería el origen del aumento en la producción del CRF que posteriormente iniciaría la respuesta de estrés en conjunción con otros (citocinas…) y que se vería reflejado en el resto del organismo a través de la implicación del sistema de hormonas, y también del sistema inmune. A este nivel se establecen una compleja serie de interacciones cuyo estudio ha dado lugar a la denominada psiconeuroendocrinología (Ader et al, 1991).
En el caso del TA se produciría la anterior secuencia de acontecimientos con la particularidad de que de forma patológica, sin la intervención de un estímulo provocador del miedo, de forma espontánea.
Un estudio de la reacción de estrés en el TA a través de los reactantes de fase aguda
Con el fin de estudiar de la reacción de estrés en el TA analizamos sus manifestaciones periféricas, esto es, los reactantes de fase aguda. A continuación se expone la metodología y resultados del análisis realizado en una muestra de pacientes extraída del “Programa de tratamiento de Pacientes con trastorno de Angustia” del hospital Universitario Marqués de Valdecilla, en Santander, España. Este protocolo pretende el estudio y tratamiento de pacientes con TA en las fases iniciales del trastorno y que no han recibido tratamiento previo (farmacológico ni psicológico)
Pacientes
Se incluyó a pacientes con criterios de trastorno de Angustia DSM-IV, diagnosticados mediante la entrevista estructurada Mini International Neuropsychiatric Interview -MINI- (Sheehan et al, 1999). Tras la confirmación del diagnóstico se administraron, entre otros, la escala de Gravedad del trastorno de pánico (PDSS) (Shear et al, 1997), e Impresión Clínica Global (Guy, 1976) para determinar la gravedad clínica.
Los Criterios de inclusión comprendían: i) Pacientes con diagnóstico principal de trastorno de Angustia con o sin agorafobia. ii) Que no hayan recibido tratamiento previo para el trastorno (p. ej. fármacos eficaces a dosis suficientes durante el tiempo necesario -2 meses previos-), iii) Pertenecientes al área de influencia de las Unidades de Salud Mental de Santander y iv) Edad mayor a 18 años.
Por otra parte, los criterios de exclusión incluían: i) comorbilidad relevante, ii) retraso mental y analfabetismo, iii) embarazo, iv) Falta reiterada de cumplimiento terapéutico y iv) Consumo de drogas, procesos infecciosos o inflamatorios, o enfermedades que afecten a los sistemas inmunológico, endocrino o metabólico.
Los pacientes, libres de tratamiento al inicio del estudio, tras la valoración y analítica preliminar, empezaron un tratamiento naturalístico con Inhibidores Selectivos de recaptación de Serotonina (ISRSs). Al cabo de 8 semanas fueron evaluados de nuevo para determinar la respuesta clínica y la evolución de las variables a estudio. La respuesta se determinó como una puntuación de “mejor” o “mucho mejor” en la ICG y tener una puntuación en la PDSS de al menos 30% por debajo de la basal.
Además, se incluyeron sujetos sanos, sin patología psiquiátrica presente o pasada (valorados mediante la entrevista MINI), de similar edad sexo, edad e índice de masa corporal que los pacientes.
Determinaciones de laboratorio
Se tomaron determinaciones analíticas en ayunas mediante punción venocubital entre las 8:00 y 9:00 horas. a. m. Se determinaron los siguientes parámetros, reactantes de fase aguda:
. Fibrinógeno, mediante análisis automatizado en un Sysmex CA-6000 con reactivos DADEâ Thrombin Reagent (Dade Diagnostics S. L, Aguada, PR 00602-0865, USA).
. Proteina C reactiva, mediante inmunonefelometría en un Nefelometro Analizador de Behring (Behring, Marburg, Germany) con reactivos de Behring Diagnostics Inc (Somerville, NJ, USA).
. Albúmina y gamma-globulinas, de manera automatizada en un Hitachi 704 (Hitachi, Tokyo, Japan).
. Interleukina-6 mediante un enzimoinmunoanálisis ultrasensible Cytoscreen USTM de BIOSOURCE (BioSource International, Camarillo, CA, USA).
. Cortisol (pg/ml) por RIA (radioinmunoensayo), (DPC, Los Angeles, CA, USA).
Los resultados se analizaron tonel programa SPSS 8. 0. Se utilizó el T test, con transformación logarítmica de los valores de PCR e Interleukina 6 al no seguir una distribución normal.
Resultados
Los datos de la muestra se reflejan en la tabla 1.
Tabla 1. Pacientes y controles incluidos
La muestra de pacientes tenía una edad de inicio del TA a los 29 años, con una mediana de 6 meses de evaluación de la enfermedad. Casi un tercio de los pacientes sufrían agorafobia (65%). Respecto a la respuesta al tratamiento, al cabo de 8 semanas con ISRSs, el 71% de los pacientes presentaron una respuesta clínica tal como se ha definido.
En la comparación de pacientes y controles sanos, los valores de PCR y cortisol presentaban diferencias significativas. Los pacientes, mostraban un aumento de PCR (0, 22 ± 0, 29) comparados con los voluntarios sanos (0. , 8 ± 0, 08) p= 0, 03. Por otro lado, el cortisol basal en pacientes también era superior que en sujetos sanos (22, 2 ± 6, 5 vs 18, 3 ± 5, 9; p= 0. 01). El resto de los parámetros no mostraba diferencias significativas.
Tras el seguimiento, se determinaron al cabo de 8 semanas los parámetros de los pacientes para compararles con los valores iniciales. Los resultados de los pacientes de los que se disponía de la determinación en los dos puntos y que respondieron al tratamiento se muestran en la tabla 2.
Tabla 2. Resultados de los pacientes "respondedores" al inicio y tras 8 semanas de tratamiento.
Tras el seguimiento, los valores de albúmina y cortisol presentaban una disminución, y los de gammaglobulinas un aumento significativos.
Cuando analizamos los valores de los pacientes al inicio, hallamos que los no respondedores al tratamiento presentaban unos niveles iniciales de albúmina más bajos (4, 22 vs. 4, 45; p=0, 04).
De hecho, la escala ICG-cambio tras el seguimiento correlacionaba con los niveles iniciales de albúmina (p<0. 001) (Figura 2), pero también de gammaglobulinas (p=0. 002) (Figura 3).
Figura 2
Figura 3
Para determinar el grado de asociación entre estas variables al inicio y el grado de mejoría, se realizó una regresión lineal. En ella, los niveles iniciales de gammaglobulinas eran los que mejor predecían la respuesta al tratamiento, explicando un 22% de la varianza de la mejoría tras el seguimiento.
Conclusiones
Podemos concluir de los resultados de este estudio diciendo que los pacientes con TA en las primeras fases de la enfermedad presentan una reacción de fase aguda, que esta reacción tiende a remitir tras un tratamiento con ISRSs, y finalmente, que lso reactantes de fase aguda pueden ser utilizados como predoctores de la respuesta al tratamiento.
Agradecimientos
Este estudio ha sido posible gracias a una Beca de Investigación de la Fundación Marqués de Valdecilla (A/24/01).
Referencias
Ader, R. A. , Felten, D. L. , and Cohen, N. (ed. ) (1991). Psychoneuroimmunology (2nd edn). Academic Press, San Diego, CA.
Amado JA, Flórez J. Hormonas adenohipofisarias e hipotalámicas. En: Flórez J, Armijo JA, Mediavilla A. Farmacología humana. Tercera Edición. Barcelona: Masson; 1997. p. 845-866.
Boyer P. Do anxiety and depresión have a common pathophysiological mechanism?. Acta Psychiatr Scand 2000; 102 (Suppl 406): 24-29.
Fink G, Dow RC, Casley D, Johnston CI, Lim AT, Copolov DL, Bennie J, Carroll S, Dick H. Atrial natriuretic peptide is a physiological inhibitor of ACTH release: evidence from immunoneutralization in vivo. J Endocrinol 1991; 131: R9-12.
Gorman JM, Kent JM, Sullivan GM, Coplan JD. Neuroanatomical hypothesis of panic disorder, revised. American Journal of Psychiatry 2000; 157: 493-505.
Guild SB, Cramb G Characterisation of the effects of natriuretic peptides upon ACTH secretion from the mouse pituitary. Mol Cell Endocrinol 1999; 152: 11-19.
Guy W, ed (1976): ECDEU Assessment Manual for psychopharmacology, Revised. Rockville, Md: National Institute of Mental Health. Dept of Health, Education, and Welfare publication (ADM) 76-338.
Habib KE, Weld KP, Rice KC, Pushkas J, Champoux M, Listwak S, et al. Oral administration of a corticotropin-releasing hormone receptor antagonist significantly attenuates behavioral, neuroendocrine, and autonomic responses to stress in primates. Proc Natl Acad Sci. 2000; 97: 6079-6084.
Kellner M, Herzog L, Yassouridis A, Holsboer F, Wiedemann K. Possible role of atrial natriuretic hormone in pituitary-adrenocortical unresponsiveness in lactate-induced panic. Am J Psychiatry 1995 Sep; 152(9):1365-
Kellner M, Knaudt K, Jahn H, Holsboer F, Wiedemann K. Atrial natriuretic hormone in lactate-induced panic attacks: mode of release and endocrine and pathophysiological consequences. J Psychiatr Res 1998; 32: 37-48.
Kishimoto T, Radulovic J, Radulovic M, Lin CR, Schrick C, Hooshmand F, et al. Deletion of crhr2 reveals an anxiolytic role for corticotropin-releasing hormone receptor-2. Nat Genet 2000; 24: 415-419.
LeDoux JE. Emotion circuits in the brain. Annu Rev Neurosci. 2000; 23: 155-184.
Sapolsky RM, Romero LM, Munck AU. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions. Endocrine Reviews 2000; 21: 55-89.
Shear MK, Brown TA, Barlow DH, Money R, Sholomskas DE, Woods SW, Gorman JM, Papp LA. Multicenter collaborative panic disorder severity scale. Am J Psychiatry 1997; 154: 1571-1575.
Sheehan D, Janavs J, Baker R, Harnett-Sheehan K, Knapp E, Sheehan M, et al. (1999) The Mini International Neuropsychiatric Interview (MINI). J Clin Psychiatry 60 (suppl 18): 39-62.
Steckler T, Holsboer F. Corticotropin-releasing hormone receptor subtypes and emotion. Biological Psychiaty 1999; 46: 1480-1508.
Strohle A, Kellner M, Holsboer F, Wiedemann K. Anxiolytic activity of atrial natriuretic peptide in patients with panic disorder. Am J Psychiatry 2001; 158: 1514-1516.
Whicher JT. Acute phase proteins, physiology and clinical uses. Clin Biochem Revs 1990; 11: 4-9.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.
Tratamiento cognitivo-conductual de un trastorno de angustia con agorafobia: a propósito de un caso.
Raquel Remesal Cobreros et. al
Fecha Publicación: 23/03/2011
Tratamiento cognitivo-conductual de un trastorno de angustia con agorafobia: a propósito de un caso.
E. Torrico Linares
Fecha Publicación: 12/12/2010
Predictive variables of the response to pharmacological treatment in panic disorder.
A. Herrán et. al
Fecha Publicación: 02/06/2010
Stress response as a model in panic disorder.
Andrés Herrán et. al
Fecha Publicación: 28/05/2010
El modelo de reacción de estrés en el Trastorno de Angustia.
Deirdre Sierra Biddle
Fecha Publicación: 05/07/2003
Morbilidad cardiovascular en pacientes con trastornos de ansiedad. Papel de los mediadores de la inflamación.
Deirdre Sierra-Biddle
Fecha Publicación: 01/01/2003