El síndrome neuroléptico maligno (SNM) es una complicación clásicamente relacionada con la medicación neuroléptica, aunque actualmente se sabe que puede aparecer saciado a otros tratamientos, es poco frecuente pero importante debido a su elevada mortalidad. Fue descrito por primera vez por Delay y col. en 1960 (1) tras la introducción de los neurolépticos como "síndrome acinético hipertónico". Estudios retrospectivos estiman su incidencia en 0. 02-3. 23 % de los pacientes que reciben neurolépticos. Esta variación en la frecuencia se debe a las diferencias en los criterios diagnósticos (2, 3), el tipo de población a estudio, enfermos agudos o crónicos, tipo de hospital y tipo de tratamiento.
Es dos veces más frecuente en hombres y entre sujetos de 20 a 50 años (población en la que es más frecuente el uso de neurolépticos). La mortalidad se encuentra entre el 10 y 30%. Se han descrito casos de SNM tanto con los nerolépticos clásicos como con los neurolépticos atípicos no quedando claro el papel que juega la medicación concomitante en el desarrollo de SNM en estos casos (4, 5, 6, 7, 8). También se han descrito casos de SNM tras la suspensión de agentes dopaminérgicos (como l-dopa y Amantadina), por el uso de antieméticos como metoclopramida y antidepresivos tricíclicos.
Actualización en síndrome neuroléptico maligno.
Iván Lerma Carrillo1; Santiago Añó Torres2; Cloe Llorente Sarabia2; Marta Presa García2; Javier Conejo Galindo3.
1) Medico Interno Residente, 2º año. Servicio de psiquiatría. hospital Rodríguez Lafora. Madrid.
2) Medico Interno Residente, 2º año. interconsulta y psiquiatría de Enlace. Servicio de psiquiatría II. HGU Gregorio Marañón. Madrid.
3) Adjunto de psiquiatría. interconsulta y psiquiatría de Enlace. Servicio de psiquiatría II. HGU Gregorio Marañón. Madrid.
Introducción
El síndrome neuroléptico maligno (SNM) es una complicación clásicamente relacionada con la medicación neuroléptica, aunque actualmente se sabe que puede aparecer saciado a otros tratamientos, es poco frecuente pero importante debido a su elevada mortalidad. Fue descrito por primera vez por Delay y col. en 1960 (1) tras la introducción de los neurolépticos como “síndrome acinético hipertónico”.
Estudios retrospectivos estiman su incidencia en 0. 02-3. 23 % de los pacientes que reciben neurolépticos. Esta variación en la frecuencia se debe a las diferencias en los criterios diagnósticos (2, 3), el tipo de población a estudio, enfermos agudos o crónicos, tipo de hospital y tipo de tratamiento. Es dos veces más frecuente en hombres y entre sujetos de 20 a 50 años (población en la que es más frecuente el uso de neurolépticos). La mortalidad se encuentra entre el 10 y 30%. Se han descrito casos de SNM tanto con los nerolépticos clásicos como con los neurolépticos atípicos no quedando claro el papel que juega la medicación concomitante en el desarrollo de SNM en estos casos (4, 5, 6, 7, 8). También se han descrito casos de SNM tras la suspensión de agentes dopaminérgicos (como l-dopa y Amantadina), por el uso de antieméticos como metoclopramida y antidepresivos tricíclicos.
Fisiopatología
El SNM es el resultado de una compleja interacción entre fármacos que actúan sobre las vías dopaminégicas y un sujeto susceptible.
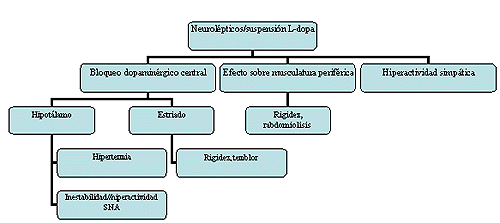
Pese a no conocerse con exactitud el mecanismo fisipatológico, se han propuesto dos teorías para explicar la fisiopotología del SNM (fig . 1) (9)
Fig. 1. Fisiopatología del SNM
La primera está en relación con el aumento de la termogénesis provocada por la depleción/bloqueo de dopamina en las vías dopaminérgicas. La serotonina interviene en la termogénesis por su estimulación en el hipotálamo, la dopamina inhibe este proceso. Los neurolépticos producen un bloqueo dopaminérgico, desinhibiendo la liberación de serotonina que tiene como resultado un aumento de la termogénesis. Pero como la termorregulación a nivel central está mediada también por vías noradrenérgicas, serotoninérgicas y colinérgicas (las propiedades anticolinérgicas de los neurolépticos favorecen al aumento de temperatura al inhibir la sudoración e impidiendo disipar el calor corporal), en la génesis del SNM probablemente intervengan más factores que aún están por aclarar. Por otro lado la dopamina puede inhibir la contracción del músculo esquelético, por lo que el bloqueo dopaminérgico daría como resultado un aumento en la contracción del músculo esquelético. Este aumento del tono muscular implica también un aumento de temperatura. En esta dirección apuntan los casos de SNM descritos tras la supresión de fármacos dopaminérgicos, amantadina y l-dopa, y el uso empírico del agente dopaminérgico bromocriptina en el tratamiento del SNM.
La segunda teoría está en relación con las similitudes entre el SNM y la hipertermia maligna. Se sugiere que los neurolépticos y otros fármacos pueden producir en el músculo esquelético un estado tóxico/hipermetabólico asociado a un incremento de la liberación de calcio desde el retículo sarcoplasmnático, produciendo hipertermia, rigidez y aumento de la CPK. Esta teoría apoyaría el uso de dantroleno en el tratamiento del SNM.
Factores de riesgo
Existen factores fisiológicos y ambientales que predisponen al desarrollo de SNM (10). El más conocido es la deshidratación. También se consideran factores de riesgo (por favorecer la deshidratación) la agitación, la ingesta oral pobre y la temperatura ambiental elevada. Los pacientes que han sufrido un primer episodio de SNM tienen mayor riesgo. Altas dosis de neurolépticos, especialmente si son intramusculares, aunque otros autores sugieren que el SNM es dosis-independiente y puede aparecer con las dosis standard de neurolépticos. Otros factores de riesgo son: introducción rápida del neuroléptico, neurolépticos depot, medicación concomitante (especialmente litio), bajo control de los síntomas extrapiramidales (SEP) inducidos por neurolépticos, SEP resistentes al tratamiento, suspensión de fármacos antiparkinsonianos, diagnóstico de trastorno afectivo, alcoholismo, síndrome cerebral orgánico, daño cerebral previo, trastorno extrapiramidal (Parkinson, Corea de Huntington) y catatonia. Existen evidencias de que el déficit de hierro es un factor de riesgo para el desarrollo de SNM y otros trastornos del movimiento (acatisia y el mioclonus nocturno) aunque está asociación puede ser más aparente que real. Aunque se han recogido asociaciones familiares no se considera que el riesgo par SNM pueda trasmitirse genéticamente.
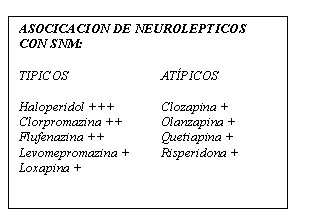
Todos los neurolépticos tienen algún riesgo de inducir SNM (tabla 1). Aunque se pensaba que los atípicos presentaban menos riesgo, se han recogido casos de SNM con clozapina, olanzapina, risperidona, y quetiapina.
Tabla 1. Neurolépticos asociados al SNM
El haloperidol y el decanoato de flufenazina son los neurolépticos asociados en la mayoría de los casos de SNM recogidos en la literatura. Pero no se puede afirmar con seguridad que estos fármacos predispongan a desarrollar SNM con mayor frecuencia que otros agentes, ya que su uso está mucho más extendido que el del resto de fármacos de su grupo. Además, existe la tendencia de tratar con haloperidol (en general con dosis altas y escaladas rápidas) a pacientes que padecen cuadros de agitación o psicosis más graves que los tratados con otros fármacos.
Por lo que el mayor número de casos de SNM descritos con haloperidol podría estar más en relación con las circunstancias, con múltiples factores de riesgo para SNM, en las que se usa este fármaco que con las propiedades intrínsecas del mismo.
La mayoría de SNM aparecen tras el inicio o el incremento de la dosis de neurolépticos, raramente aparece tras la suspensión de la medicación.
Clínica
Se han propuesto multitud de criterios para el diagnóstico de SNM, pero debido a la variabilidad en su presentación clínica resulta difícil su aplicación universal (Tabla 2. y tabla 3. ).
Tabla 2. Criterios diagnósticos DSM-IV para el SNM
Tabla 3. Criterios diagnósticos de Levenson para el SNM (12)
Para el diagnóstico de SNM según el DSM-IV es preciso que la sintomatología se asocie al uso de neurolépticos (11). Aunque se sabe con bastante certeza que el SNM puede aparecer tras la supresión de fármacos como la l-dopa, agonistas dopaminérgicos (p. ej. Bromocriptina) y la amantadina. El empleo de diferentes criterios para el diagnóstico ha dado lugar a una gran variabilidad en los datos epidemiológicos de este síndrome. Clínicamente se caracteriza por rigidez muscular, fiebre (>38. 5°C), alteración del nivel de conciencia, tensión arterial anormal (generalmente hipertensión), diaforesis, taquicardia, taquipnea, mutismo, corea, movimientos tonico-clónico generalizados, trismus y opistótonos. Dentro de los hallazgos de laboratorio se encuentra el aumento de los niveles de CPK, leucocitosis, mioglobinuria y aumento de los niveles de transaminasas.
No existe una secuencia típica en el desarrollo de los síntomas, pero generalmente la sintomatología extrapiramidal que no responde a anticolinérgicos aparece antes que la disfunción autonóma. El número de síntomas y la gravedad de éstos puede ser muy variable. Por lo tanto, ante un cuadro de rigidez e hipertermia en un paciente con inicio reciente de tratamiento neuroléptico el grado de sospecha de SNM debe ser alto.
El SNM puede manifestarse a lo largo de un continuo tanto de síntomas como de severidad. Es decir, 2 o más síntomas leves, moderados o severos.
Los síntomas generalmente se desarrollan entre 24 y 72 horas y pueden duran de 1 a 44 días (10 días de media). En el caso de los neurolépticos depot tanto la instauración como la resolución del cuadro puede ser más lenta.
Diagnóstico diferencial
En el diagnóstico diferencial del SNM se incluyen varios cuadros (Tabla 4) poco prevalentes pero que dada la gravedad del cuadro hay que tener en cuenta.
El estudio debería incluir una historia clínica detallada, exploración física y pruebas de laboratorio que incluyan: recuento de leucocitos, test de función renal, electrolitos, CPK sérica, mioglobinuria y niveles séricos de litio. Para descartar otros diagnósticos estaría indicado TAC craneal y punción lumbar.
Tabla 4. diagnóstico diferencial del SNM.
Complicaciones
El término “maligno” hace referencia a las complicaciones potencialmente letales de este síndrome (Tabla 5). La mortalidad ha descendido del 25% a aproximadamente un 10% en los últimos 20 años probablemente debido a un mejor reconocimiento del síndrome y a una intervención temprana.
Tabla 5. Complicaciones más frecuentes del SNM.
Las complicaciones del SNM normalmente son consecuencia de la rigidez extrema y la inmovilización que provoca. La ingesta pobre de agua favorece la deshidratación, aumentando el riesgo de rabdomiolisis, de mioglobinuria y fallo renal agudo. La insuficiencia renal aguda requiere diálisis. Se considera el principal predictor de muerte, con una frecuencia asociada del 50%.
La trombosis venosa profunda y el tromboembolismo pulmonar es otra consecuencia de la rigidez, la inmovilización y la deshidratación y es la responsable de ¼ de las muertes provocadas por el SNM. La dificultad para tragar y la alteración de la conciencia favorece la aspiración y la neumonía que suele precisar ventilación mecánica en una unidad de cuidados intensivos.
Los pacientes en tratamiento con litio durante el SNM tienen un mayor riesgo de sufrir daño cerebral como consecuencia de la hipertermia.
Tratamiento
Para el tratamiento es esencial el reconocimiento temprano de los síntomas, la suspensión precoz del tratamiento neuroléptico y el soporte vital como la reducción de la fiebre, hidratación y nutrición hasta que los niveles de neurolépticos en sangre hayan descendido 13, 14.
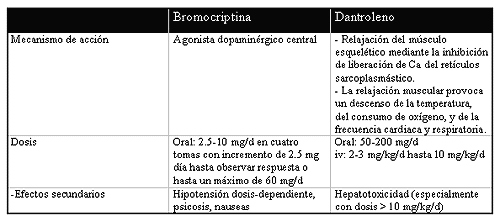
El uso de terapias específicas es un tema controvertido. La bromocriptina y el dantroleno son los fármacos más empleados (Tabla 6). El uso de dantroleno sódico, como en la hipertermia maligna, no está claro; aunque se continúa administrando para reducir la temperatura corporal y relajar la musculatura periférica mediante la inhibición de la liberación de calcio del retículo sarcoplasmástico. La dosis recomendada es de 2 mg/kg iv, repetido cada 10 minutos si es necesario hasta un máximo de 10mg/kg al día. Por su hepatotoxicidad se usa en la fase aguda durante los primeros días.
Tabla 6.
La bromocriptina (agonista dopaminérgico) mejora la rigidez muscular en pocas horas, seguido de una reducción de la temperatura y una mejoría un la tensión arterial. Se han usado con éxito dosis de hasta 2. 5-10 mg hasta 4 veces al día. El efecto secundario más común es la hipotensión, pudiendo ser moderada o severa, el tratamiento será similar al de otras causas de hipotensión.
El dantroleno y la bromocriptina pueden utilizarse simultáneamente sin que esto aumente los efectos secundarios específicos de cada fármaco.
Amantadita y Levodopa-Carbidopa han sido empleados con éxito para disminuir la hipertermia en pacientes con SNM aunque todavía no iste suficiente evidencia para recomendar su empleo sistemático.
El tratamiento del SNM debe mantenerse durante 2-3 semanas hasta la remisión de los síntomas.
La terapia Electroconvulsiva (TEC) es eficaz para tratar algunos de los componentes del SNM como la fiebre, la sudoración y la alteración de la conciencia. Se especula que este efecto beneficioso se debe a que la TEC favorece la actividad dopaminérgica cerebral. Se recomnienda específicamente TEC en los siguientes casos:
- En casos de SNM severo refractario al tratamiento médico.
- Cuando es imposible realizar un diagnóstico diferencial entre SNM y Catatonia Letal o si predominan los síntomas catatoniformes.
- Para el tratamiento de la catatonia residual psicosis en el periodo post-SNM inmediato.
- Cuando el cuadro psiquiátrico de base es depresión psicótica o catatonia.
Las complicaciones que pueden aparecer en la evolución del SNM deben ser tratadas de forma agresiva (insuficiencia renal, insuficiencia respiratoria).
Tras un episodio de SNM la terapia con neurolépticos sigue siendo necesaria para el control de los síntomas psiquiátricos. Siendo esto uno de los principales problemas, ya que el síndrome recurre en 5 de cada 6 paciente si se reintroduce el mismo neuroléptico a la misma dosis. El uso de un neuroléptico de menor potencia es seguro en 9 de cada 10 casos. Se recomienda comenzar con un neuroléptico atípico a dosis bajas e ir aumentando progresivamente la dosis mientras se monitorizan los signos del SNM. La hidratación es una de las principales medidas preventivas para evitar la recurrencia.
Bibliografía
1. Delay J, Pichot P, Lempiere T, Blissalde B, Peigne F. Un neuroleptique majeur non phenothiazinique et non résepinique, l´haloperidol, dans le treitment des psicosis. Ann Med Psicol. . 1960, 18:145-52.
2. Lazarus A, Mann SC, Caroff SN. The neuroleptic malignant syndrome and related conditions. Washington DC, American Psychiatric Press, 1989.
3. Hasan S, Buckley P. Novel antipsychotic and the neuroleptic malignant syndrome. Biol Psychiatry. 1998, 44(6):278-81.
4. Adityanjee, aderibigbe YA, Mathews T. Epidemiology of neuroleptic malignant syndrome. Clin Neuropharmacol. 1999, 22(3):151-8.
5. Kogoj A, Velikonja I. Olanzapine induced neuroleptic malignant syndrome—a cese review. Hum Psychopharmacol. 2003, 18(4):301-9.
6. Sachdev P, Kruk J, Kneebone M. Clozapine –induced neuroleptic malignant syndrome: review and report of new cases. J Clin Psychopharmacol. 1995, 15: 365-371.
7. Dave M. Two cases of risperidone-induced neuroleptic malignant syndrome. AM J Psychiatry. 1995, 152:1234.
8. García G, Ghani S, Poveda RA, Dansky BL. Neuroleptic malignant syndrome with antidepressant/antipsychotic drug combination. Ann Pharmacother. 2001. 35(6):784-5.
9. Adnet P, Lestavel P, Kivesic-Horber R. Neuroleptic malignant syndrome. BR J Anaesth. 2000, 85(1):129-35.
10. Bhanushali MJ, Tuite PJ. The evaluation and management of patient with neuroleptic malignant syndrome. Neurol Clin AM. 2004, 22(2):389-411.
11. Manual diagnóstico y estadístico de los trastornos mentales. Edición en castellano. Masson 2003.
12. Levenson J. Neuroleptic malignant syndrome. AM j Psychiatry 1985, 142:1137-45.
13. Velamoor VR, Swamy GN et al. Management of suspected neuroleptic malignant syndrome. Can J Psychiatry. 1995, 40:545-549.
14. Carooff SN, Mann SC. Specific treatment of neuroleptic malignant syndrome. Biol Psychiatry. 1998, 44:378-381
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.




Síndrome neuroléptico maligno, la importancia de una correcta detección
Javier Sánchez González et. al
Fecha Publicación: 18/05/2023
Síndrome Neuroléptico Maligno y Síndrome Serotoninérgico. A propósito de un caso.
IRENE PÉREZ SAGASETA DE ILURDOZ et. al
Fecha Publicación: 18/05/2023
SÍNDROME NEUROLÉPTICO MALIGNO TRAS ARIPIPRAZOL DE LARGA DURACIÓN EN PACIENTE CON SARS-COV2
Maria Soledad Olmeda Garcia et. al
Fecha Publicación: 12/01/2023
Síndrome Neuroléptico Maligno. A propósito de un caso
Cristina Martínez García et. al
Fecha Publicación: