Las dietas disociadas, en particular la manipulación proteica, son un arma terapéutica que no debemos menospreciar. Dos importantes neurotransmisores afectados en patologías tan importantes como la esquizofrenia están, en mayor o menor medida, vinculados a la ingesta de sus aminoácidos precursores. La serotonina se ve afectada por la ingesta de triptófano que es a su vez influida por el tipo de alimentos con los que se ingiere. La dopamina, en menor medida, también está relacionada con la ingesta de tirosina y fenilalanina.
En esta revisión se estudian los procesos metabólicos en los que se basa esa posible manipulación, y se dan consejos sobre el tipo de terapias complementarias se pueden utilizar en el manejo de unas patologías tan heterogéneas y de tan mal pronóstico como las enfermedades del espectro esquizofrénico.
Manipulación proteica en las enfermedades mentales asociadas a alteraciones de la serotonina y dopamina (esquizofrenia).
(Protein manipulation in mental diseases related to altered serotonin and dopamine (schizophrenia). )
José Antonio Villegas; Irene Villegas.
Cátedra de Fisiología de la Universidad Católica de Murcia
Campus de Los Jerónimos s/n. Guadalupe
C. P: 30107 Guadalupe
Murcia
PALABRAS CLAVE: esquizofrenia, Serotonina, Dopamina, Triptofano, Tirosina, Fenilalanina.
(KEYWORDS: Schizophrenia, Serotonine, Dopamine, Tryptophan, Phenylalanine, Tyrosine. )
página 1
[18/2/2004]
Resumen
Las dietas disociadas, en particular la manipulación proteica, son un arma terapéutica que no debemos menospreciar. Dos importantes neurotransmisores afectados en patologías tan importantes como la esquizofrenia están, en mayor o menor medida, vinculados a la ingesta de sus aminoácidos precursores. La serotonina se ve afectada por la ingesta de triptófano que es a su vez influida por el tipo de alimentos con los que se ingiere. La dopamina, en menor medida, también está relacionada con la ingesta de tirosina y fenilalanina. En esta revisión se estudian los procesos metabólicos en los que se basa esa posible manipulación, y se dan consejos sobre el tipo de terapias complementarias se pueden utilizar en el manejo de unas patologías tan heterogéneas y de tan mal pronóstico como las enfermedades del espectro esquizofrénico.
Abstract
Dissociated diets, specially with protein manipulation, are a therapeutic weapon to be considered. Two of the most important neurotransmitters affectec in schizophrenia are, to a certain extent, related to the intake of their precursor amino acids. Serotonin is affected by tryptophan intake, that is itself influenced by the kind of food we are taking with. Dopamine, to a lesser extent, is also related to tyrosine and phenylalanine intake. In this review, we study metabolic processes on which this manipulation is based and we give advice about the kind of complementary therapies that can be used to deal with diseases that are so heterogeneous and with bad prognosis as schizophrenia.
Las dietas disociadas siempre han sido menospreciadas por los expertos en nutrición, ya que han considerado que tomar una dieta equilibrada y variada es la mejor apuesta para prevenir cualquier déficit nutricional. Sin embargo, un mayor conocimiento hoy día referente a la nutrición, nos permite plantear este tipo de dietas, en las que hay un desequilibrio en el aporte de macronutrientes de manera que podamos compensar esos déficits y, al tiempo, podamos aprovecharnos de las ventajas de esa manipulación.
En la esquizofrenia (ESQ) gran parte del arsenal terapéutico se basa en bloquear receptores dopaminérgicos y/o serotoninérgicos. Pues bien, tanto la dopamina como la serotonina tienen precursores en aminoácidos (tirosina y triptófano) cuya manipulación en la ingesta tiene repercusión, en mayor o menor medida, en la concentración en el cerebro de dichos precursores.
Aunque, desafortunadamente, no es tan sencillo como que la disminución de la ingesta del precursor se continúe con una disminución de la concentración cerebral del neurotransmisor y eso lleve a una disminución de la clínica de la enfermedad, sin embargo, si hay argumentos serios como para considerar que podemos ayudar a controlar algunos síntomas conociendo el metabolismo de algunos aminoácidos. Vamos a dar un repaso al triptófano como precursor de la serotonina y a la tirosina y fenilalanina como precursores de la dopamina.
Triptófano
- DESCRIPCIÓN
Es un aminoácido (AA) aromático, apolar y presenta un anillo indólico en su cadena lateral con capacidad de establecer enlaces débiles con estructuras semejantes, por lo cual se clasifica como un aminoácido hidrofóbico. Se trata de un AA esencial y clave en la síntesis de unos de los neurotransmisores más importantes, la serotonina (5-Hidroxitriptamina, 5-HT).
- INGESTA, ABSORCIÓN Y CIRCULACIÓN PLASMÁTICA
El aporte de TRP son los alimentos ricos en proteínas de alto valor biológico (carnes, pescados, huevos, lácteos). La absorción se realiza sobre todo en duodeno y yeyuno mediante sistemas de transporte activo secundario dependiente de gradientes de Na+.
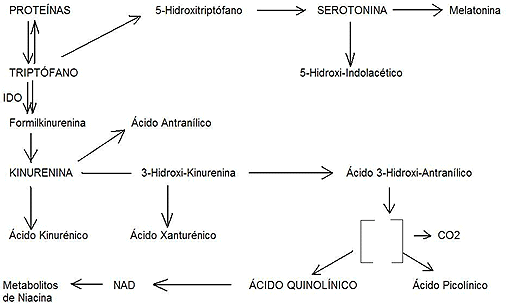
Posteriormente el TRP va vía Porta al hígado en donde sufre una metabolización parcial por dos enzimas, La triptófano 2, 3-dioxigenasa (TDO) y la indolamina 2, 3-dioxigenasa (IDO). La TDO es inducida por los glucocorticoides y puede aumentar hasta 10 veces cuando se da TRP en la dieta. La IDO es inducida por factores que activan el sistema inmune como: las interleuquinas 1 y 2, los interferones gama y beta, el lipopolisacárido bacteriano (LPS) y algunos virus como el virus de la inmunodeficiencia humana.
Aquí podríamos hipotetizar de la siguiente forma: Factores externos como la alimentación (alteración en la relación ácidos grasos Omega3/Omega6; teoría de la membrana) o infección por determinados virus (teoría vírica), provocan un aumento de mediadores de la inflamación, lo que induce la expresión de IDO que a su vez provoca dos fenómenos simultáneos, por un lado provoca un aumento de la síntesis de ácido quinolínico que actúa sobre los AA excitatorios y receptores NMDA con el resultado de neurotoxicidad, y por otro lado, disminuyendo la cantidad de TRP en plasma y, por tanto, de serotonina (ambos factores relacionados con enfermedades mentales, en particular la ESQ) (Wirleitner B et al. 2003).
Normalmente la vía de metabolización del TRP por las enzimas IDO y TDO es activa en hígado, fundamentalmente, pero cuando hay un proceso autoinmune o inflamatorio en el cerebro, esta vía se activa, provocando un círculo vicioso neurotóxico. Pues bien, muy recientemente el descubrimiento de anticuerpos antiserotonina en la psicosis esquizoafectiva (Schott K et al. 2003) ha abierto un nuevo campo de investigación.
Otra conexión muy interesante es la que relaciona un producto del TRP vía IDO que es el ácido picolínico como estimulador del interferón gamma (INFg), un importantísimo inmunomodulador con efectos antiproliferativos y antineoplásicos capaz de inducir la expresión de la IDO en diferentes células. Si esta vía estuviera sobreactivada, una consecuencia sería la ausencia de tumores, algo que estimuló siempre la curiosidad de los psiquiatras que han tratado enfermos de esquizofrenia y que han constatado en diversos estudios la menor afectación por cáncer de estos pacientes a pesar de los altos factores de riesgo derivados de actividades como fumar (que en estos pacientes alcanza a más de un 70%) (McCloughen A et al. 2003).
Aquí podríamos reunir diversas piezas del puzzle, de forma que tendríamos por un lado un componente excitatorio (predominio catabólico de la teoría de la membrana) con formación de citoquinas, bradiquinina (teoría de la inflamación) y óxido nítrico, lo que activaría los nociceptores de la periferia. El ácido quinolínico activaría las neuronas nociceptivas y produciría neurotoxicidad vía activación de N-metil-D-aspartato.
Por otro lado, Heyes MP et al. observaron en macacos infectados por el virus de la poliomielitis que la kinurenina-3-hidroxilasa estaba incrementada, con aumento de la formación de quinolínico y neurotoxicidad (conexión con la teoría vírica).
Finalmente, otra conexión interesante es la que liga al estrés crónico que provoca un aumento de cortisol ( expresión de TDO, con aumento de ácido quinolínico), ¯ niacina, daño cognitivo (signos negativos de la ESQ) y deterioro en la síntesis del hem aun con leves deficiencias de hierro (Oduho GW et al. 1994). Bien, pues ¿qué provocaría una mejoría en los síntomas de déficit en los enfermos con ESQ según lo que acabamos de decir?. Curiosamente acaba de publicarse un trabajo en el que se encuentra una mejoría en las capacidades cognitivas en pacientes con ESQ a los que se da eritropoyetina (Ehrenreich H et al. 2003).
ACTUACIÓN EN EL PRIMER PASO
En primer lugar deberíamos actuar evitando los factores que incrementan la actividad de las enzimas IDO y TDO, ya que están claramente implicadas en la génesis de productos metabólicos tóxicos. Hay que evitar el estrés crónico, identificar y actuar frente a agentes víricos que provoquen la estimulación del interferón gamma (INFg), dar niacina de modo que creemos una inhibición enzimática por producto y cuidar la ingesta de antioxidantes.
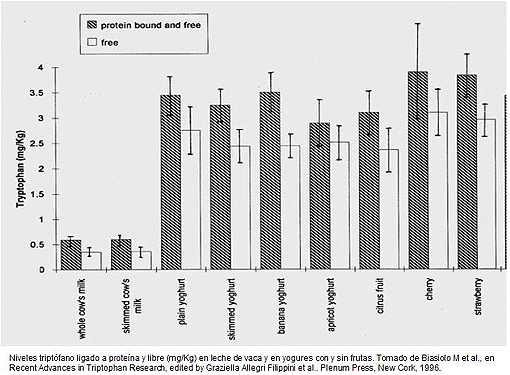
Dar triptófano en cantidades altas puede ser contraproducente ya que activamos la TDO, más bien se trataría de cuidar la ingesta de alimentos ricos en TRP (como el yogur) y tomar una dieta rica en carbohidratos que, como veremos, aumenta la cantidad de TRP libre por la acción insulínica.
Otro factor importante sería verificar el nivel de ferritina en plasma para comprobar el estado del hierro en el organismo y, en caso de estar baja, habría que plantearse una dieta rica en hierro hem (sangre, hígado, moluscos), asociando vitamina C, o en casos más extremos, dar eritropoyetina, tal como se comentaba en el estudio citado anteriormente.
- PASO DE LA BARRERA HEMATOENCEFÁLICA
Si la metabolización en hígado es normal, una parte de TRP pasará a plasma, en donde circulará en su mayor parte unido a un transportador (albúmina), de modo que tan sólo un 10-20% circulará como TRP libre. Teniendo en cuenta que en cualquier dieta habitual, el TRP es el menos abundante de todos los aminoácidos, podemos decir que una dieta típica occidental proporcionará de 1 a 1, 5 g/día. Todo ello hace que el cerebro reciba menos del 1% del TRP ingerido (Young SN y Teff KL 1989).
A partir de aquí, vamos a hacernos algunas preguntas:
¿Quién atraviesa la barrera hematoencefálica, la serotonina o el triptófano?
Pues, debido a que la 5-HT no puede atravesar la barrera hematoencefálica y a que su precursor, el TRP, sí puede, la concentración de este neurotransmisor en el cerebro será muy dependiente de la concentración de TRP en sangre (Williams W et al. 1999).
¿Por qué esta dependencia tan grande?. Supongamos que tenemos una alta cantidad de triptófano en plasma. ¿No se saturará el paso a serotonina al aumentar mucho la concentración de TRP (inhibición por sustrato)?.
La respuesta es que la enzima que cataliza el paso de TRP a 5-HT tiene una constante de Michaelis-Menten varias veces más alta que la concentración de TRP cerebral, lo que sugiere que en condiciones fisiológicas, la actividad de esta enzima no está saturada por el sustrato (generalmente, la concentración de sustrato limita la velocidad de la reacción y la constante de Michaelis-Menten, que mide la disociación del complejo enzima-sustrato, se hace despreciable frente a la concentración del sustrato cuando ésta aumenta mucho).
El segundo paso es la decarboxilación del 5-HTP a 5-HT mediante una decarboxilasa de los aminoácidos L-aromáticos que utiliza piridoxal como cofactor. La actividad de esta enzima es muy alta, por lo que todo el 5-HTP pasa a 5-HT quedando muy poco 5-HTP en el cerebro. Algo de TRP se convierte directamente en triptamina por la decarboxilasa lo que ha llevado a algunos farmacólogos a considerarla como un neurotransmisor.
Ahora bien, en este momento surge una pregunta importante. Puesto que normalmente hay una limitación enzimática para que la velocidad de una reacción no aumente mucho cuando el sustrato es muy abundante. ¿Por qué aquí no es así?. En otras palabras. ¿Por qué nuestro organismo deja en manos de la arbitrariedad de la alimentación la concentración cerebral de un neurotransmisor tan importante?
En realidad la exposición al exterior de un medio tan controlado como nuestro cerebro es un hecho extremadamente raro y, probablemente tiene que ver con la circunstancia de que las neuronas serotoninérgicas puedan participar en circuitos cerebrales con influencia sobre mecanismos periféricos que se encarguen de regular la ingesta de determinados nutrientes (Fernstrom JD 1983).
En ratas, cuando se le da a escoger al animal entre varias propuestas de alimentos de contenido proteico muy dispar, acaban ajustando su elección entre un mínimo proteico que les asegura un crecimiento rápido, y un máximo por encima del cual tendrían que forzar rutas metabólicas. Esta situación de elección instintiva de la dieta proteica que, necesariamente afecta al contenido en AA en plasma, nos lleva a considerar la posible relación entre los efectos que provocan a nivel cerebral algunos AA (TRP en particular), muy dependiente de su concentración en plasma, y la decisión de tomar un tipo de dieta en particular, más o menos hiperproteica (Peters JC 1984).
Bueno, está claro que nosotros podemos, entonces, utilizar este conocimiento para manipular la concentración de serotonina cuando consideremos que está muy baja por alguna enfermedad. Pero la siguiente pregunta es inmediata. ¿Si simplemente aumentamos el neurotransmisor cambiamos la clínica de las enfermedades que cursan con alteraciones suyas?.
En un estudio realizado en Medline y Psychlit entre los años 1966 y 1996 por Reilly JG et al. usando las palabras clave 5-hidroxitriptamina, triptófano (TRP) y depleción (depleting), encuentra que la disminución de TRP exacerba la respuesta de pánico y agresión en sujetos vulnerables. En este estudio, se cita una revisión de la literatura científica entre 1980 y 1996 que presenta 44 estudios a doble ciego sobre la disminución de TRP cuyos resultados cubre un rango de desórdenes psiquiátricos que van desde psicosis, ansiedad y desórdenes de la alimentación hasta comportamientos relacionados con el apetito, agresión y deseo.
Finalmente, en un interesantísimo estudio Williams WA et al. demostraron que tras una disminución de TRP por manipulación dietética, predomina el almacenamiento vesicular de serotonina, lo que produce un declive en la concentración de 5-HIAA en líquido cefalorraquídeo que podría explicar las alteraciones en el humor en poblaciones vulnerables observadas tras la disminución de TRP mediante dietas deficitarias en este aminoácido, o ricas en aminoácidos competidores. Estos datos los obtuvieron tras medir 5-HT y 5-HIAA en líquido cefalorraquídeo en un grupo de sujetos a los que se les había sometido a una dieta de disminución de TRP.
Digamos que en términos generales se puede decir que las dietas de depleción de triptófano por sí mismas, no causan alteraciones del humor, depresión o agresión, pero en pacientes vulnerables puede contribuir claramente. Es decir, nos puede servir para medir el grado de vulnerabilidad a determinadas enfermedades mentales (¡qué importante es prevenir!), y en este sentido hay muchos estudios de depleción del TRP (Dougherty DM et al. 1999; Williams W et al. 1999; Rubinsztein JS et al. 2001; Strüder HK and Weicker H . 2001; Young AH et al. 2002; Schmeck K et al. 2002; Hughes JH et al. 2003; Wurtman RJ et al. 2003; Rogers RD et al. 2003. )
- UTILIDAD CLÍNICA
Bien, entonces ¿se trata de dar TRP y esperar a ver si hay mejoría clínica?.
El problema es que hay que tener en cuenta lo que comentamos al principio, una alta cantidad de TRP activa la TDO y genera metabolitos que en gran cantidad son tóxicos. Habría que estar seguros de que el TRP que damos pasa a cerebro y, no suministrar una cantidad que active vías metabólicas indeseables. Para ello hay que tener en cuenta que los aminoácidos neutros compiten con el TRP en la utilización del transportador para pasar la barrera hematoencefálica. Este sistema de transporte facilitado también es utilizado para superar la barrera hematoencefálica por los aminoácidos básicos (incluyendo la lisina), glucosa y otras hexosas, adenosina, adenina, colina y ácidos monocarboxólicos, y metabolitos de neurotransmisores como 5-HIAA.
De lo anteriormente dicho se deduce, por tanto, que la síntesis de 5-HT dependerá de: a) La concentración de TRP libre en plasma (entre un 10 y un 20% del TRP total), y b) La concentración de AA neutros en plasma que utilizan el mismo transporte para atravesar la barrera hematoencefálica (Fadda F, 2000).
- ADMINISTRACIÓN DEL TRP
De este modo, tenemos que:
- Dietas con una ingesta proteica moderada no modifican el TRP en cerebro
- Dietas con una ingesta alta de proteínas disminuyen el TRP en cerebro
- Dietas con una ingesta alta de grasa aumenta el TRP libre y, por tanto, el TRP en cerebro
- Dietas ricas en glúcidos simples (alto índice glucémico, como azúcares y bollería) producen por un lado un aumento de insulina con aumento de TRP en cerebro, pero por otro una disminución de ácidos grasos en suero, con disminución de TRP libre y disminución de TRP en cerebro, aunque en esta dicotomía parece ser más activa la acción sobre la insulina, provocando un ligero aumento de TRP (Lyons PM, Truswell AS 1988).
Lista de alimentos y su contenido en triptófano. Los alimentos con menos de 100 mg de TRP por 100 g de alimento no se incluyen. (Datos obtenidos a partir de KLENSIN JC. INFOODS. Food Composition Data Interchange Handbook. United Nations University Press)
Tirosina
La tirosina es un aminoácido condicionalmente indispensable en el adulto, ya que en sujetos sanos puede ser parcialmente sintetizada por hidroxilación de la fenilalanina, de hecho, una ingesta de 21 mg/kg/d de fenilalanina provee de las necesidades de tirosina diarias (Roberts SA et al. 2001).
La tirosina es el precursor de las catecolaminas, entre las que la dopamina es de capital importancia como neurotransmisor cerebral. La comparación con el triptófano es irremediable. La manipulación dietética ¿podría alterar la síntesis de catecolaminas en el cerebro?.
Hay algunos factores que indican que es factible, el primero de ellos es la insaturación in vivo de la tirosina hidroxilasa, lo que indicaría el aumento de la síntesis de catecolaminas seguida de la ingesta de altas cantidades de tirosina. Sin embargo, mientras que la administración de tirosina incrementa los niveles de dopa, no tiene efecto sobre los niveles de dopamina cerebrales. Ahora bien, en animales a los que se daba un tratamiento que disparara los tractos dopaminérgico o noradrenérgico, los suplementos de tirosina si producían un marcado aumento de la descarga de catecolaminas. Esto parece indicar que las neuronas catecolaminérgicas se convierten en sensibles a la tirosina cuando están activas (Wurtman RJ 1992), mientras que las que se disparan a frecuencia pequeña (nigrostriatal DA) son menos sensibles (la tirosina hidroxilasa está sujeta a inhibición por producto cuando no está fosforilada, cuando se fosforila por la activación de la neurona, queda libre de inhibición) (Wurtman RJ 1987).
Si damos una dieta exenta de tirosina y fenilalanina, aumenta la prolactina en plasma y se perjudican algunas funciones cerebrales, como la memoria espacial de reconocimiento. En este sentido, hay estudios en los que se demuestra una mejor adaptación a la hipoxia y al frío en sujetos que han tomado tirosina (100 mg/kg) y han sido expuestos durante 4 horas a frío e hipoxia (Banderet LE y Lieberman HR, 1989).
En pacientes con cáncer a los que se ha dado una dieta exenta de tirosina y fenilalanina, aumentó la ansiedad y depresión (Harvie MN et al. 2002). Sin embargo, en otros estudios se ha observado que reduce los síntomas de la manía aguda (Scarnà A et al. 2003). Harmer CJ et al. en un estudio en sujetos sanos observaron alteraciones significativas en funciones en las que está implicada directamente la dopamina tras una depleción de tirosina, y en 2003 Montgomery AJ et al. ya han demostrado con técnicas de PET asociado a ciclotrón, un cambio del 6% en estriado tras una dieta exenta de tirosina y fenilalanina, por todo ello, ya está abierta la puerta a la manipulación proteica en pacientes con hiperfunción dopaminérgica.
Pues parece, por tanto, que una dieta baja en tirosina podría beneficiar la clínica “positiva” en pacientes de ESQ, de hecho, en un interesantísimo estudio, Le Masurier M et al. ya han observado (utilizando PET) la disminución de parte de la actividad estimulante de las anfetaminas tras dar una dieta libre de tirosina a ratas.
Ahora bien, la mezcla de aminoácidos sin tirosina es difícil de tomar por su sabor. Para evitar este inconveniente, se ha estudiado dar aminoácidos ramificados, que por su competencia a nivel de transporte, disminuyen la producción de dopa y posteriormente de dopamina. Los estudios en los que se da 60 g de valina, isoleucina y leucina en la proporción 3:3:4, disminuyen la tirosina (Gijsman HJ et al. 2002) (Scarnà A et al. 2003), y se aceptan bien por su sabor y palatabilidad.
Fenilalanina
Es un precursor de tirosina y, por tanto, de dopamina y del resto de catecolaminas. La ingesta de alimentos ricos en carbohidratos y grasas y pobre en proteínas aumenta la concentración de los aminoácidos aromáticos (tirosina, fenilalanina y triptófano) en cerebro. Por el contrario, una dieta rica en proteínas aumenta la concentración en cerebro de sus competidores, los aminoácidos de cadena ramificada (leucina, isoleucina y valina). Gijsman HJ et al. estudiaron una bebida de AARR con éxito en la disminución de niveles de fenilalanina y tirosina en cerebro.
La fenilalanina en altas concentraciones (200 mM), en presencia de niveles normales de tirosina inhibe la actividad de la tirosina hidroxilasa y suprime la formación de dopamina (Wurtman RJ 1987) y, en este sentido, O'Reilly R et al. encontraron niveles significativamente más altos de fenilalanina en sangre en pacientes de ESQ, mientras que Wei J et al. encontraron una alteración tirosina/fenilalanina alterada con bajos niveles de tirosina en plasma en estos enfermos.
Schultz SK et al. relacionaron la presencia de movimientos anormales en pacientes medicados con antipsicóticos, tras ayunar y dar fenilalanina, al riesgo de padecer diskinesia tardía.
Con estas premisas parecía lógico pensar en dar dietas pobres en estos aminoácidos, pues bien, Harmer CJ et al. ensayaron una bebida de aminoácidos libres de tirosina y fenilalanina que no presentaba efectos indeseables sobre la cognición, lo que ha terminado por abrir la Caja de Pandora de la manipulación proteica de manera absoluta. En este sentido, Leyton M et al. ya han utilizado en sus últimos estudios una mezcla de aminoácidos exenta de triptófano, fenilalanina y tirosina que baja en plasma las concentraciones en un 67, 78 y 77% respectivamente.
La cuestión ahora es saber si estas dietas bajas en aminoácidos precursores de neurotransmisores afectan a la clínica de los pacientes y, de momento, al menos en ratas se ha visto que la depleción de tirosina afecta a la transmisión estriatal de dopamina alterando los índices neuroquímicos y conductuales de los animales (Jaskiw GE y Bongiovanni R, 2003), es decir, no sólo bajan los niveles de neurotransmisor, sino que se ven afectadas las funciones (muy interesante. . . habrá que ver qué opinan los laboratorios farmacéuticos).
Para finalizar, el uso del PET (tomografía por emisión de positrones) permite conocer de forma no invasiva la concentración real de neurotransmisores y revolucionará la investigación en este campo. No obstante es muy esperanzador que los primeros estudios con PET sean positivos, lo que nos debe hacer ser más agresivos en la utilización de la manipulación proteica teniendo en cuenta la individualidad de cada paciente.
Bibliografía
1. Banderet LE, Lieberman HR. Treatment with tyrosine, a neurotransmitter precursor, reduces environmental stress in humans. Brain Res Bull. 1989 Apr; 22(4):759-62.
2. Ehrenreich H, Degner D, Meller J, Brines M, Behe M, Hasselblatt M, Woldt H, Falkai P, Knerlich F, Jacob S, Von Ahsen N, Maier W, Bruck W, Ruther E, Cerami A, Becker W, Siren AL. Erythropoietin: a candidate compound for neuroprotection in schizophrenia. Mol Psychiatry. 2004; 9(1):42-54.
3. Fadda F. Tryptophan-Free Diets: A Physiological Tool to Study Brain Serotonin Function News Physiol. Sci. 2000; 15: 260-4.
4. Fernstrom JD. Role of Precursor Availability in Control of Monoamine Biosynthesis in Brain. Physiol Rev. 1983 Apr; 63(2):484-546. Review.
5. Dougherty DM, Bjork JM, Marsh DM, Moeller FG. Influence of trait hostility on tryptophan depletion-induced laboratory aggression. Psychiatry Res. 1999 Nov 29; 88(3):227-32.
6. Gijsman HJ, Scarnà A, Harmer CJ, McTavish SFB, Odontiadis, Cowen PJ, Goodwin GM. A dose-finding study on the effects of branch chain amino acids on surrogate markers of brain dopamine function. psychopharmacology. 2002; 160:192–197
7. Harmer CJ, McTavish SF, Clark L, Goodwin GM, Cowen PJ. Tyrosine depletion attenuates dopamine function in healthy volunteers. psychopharmacology (Berl). 2001; 154(1):105-11.
8. Harvie MN, Campbell IT, Howell A, Thatcher N. Acceptability and tolerance of a low tyrosine and phenylalanine diet in patients with advanced cancer -- a pilot study. J Hum Nutr Diet. 2002 Jun; 15(3):193-202.
9. Heyes MP, Saito K, Lackner A, Wiley CA, Achim CL, Markey SP. Sources of the neurotoxin quinolinic acid in the brain of HIV-1-infected patients and retrovirus-infected macaques. FASEB J. 1998 Jul; 12(10):881-96.
10. Hughes JH, Gallagher P, Stewart ME, Matthews D, Kelly TP, Young AH. The effects of acute tryptophan depletion on neuropsychological function. J Psychopharmacol. 2003 Sep; 17(3):300-9.
11. Jaskiw GE, Bongiovanni R. Brain tyrosine depletion attenuates haloperidol-induced striatal dopamine release in vivo and augments haloperidol-induced catalepsy in the rat. psychopharmacology (Berl). 2003 Oct 28 [Epub ahead of print].
12. KLENSIN JC. INFOODS. Food Composition Data Interchange Handbook. United Nations University Press. The United Nations University. 53-70 Jingumae 5-chome, Shibuya-ku. Tokyo 150, Japan
13. Le Masurier M, Houston G, Cowen P, Grasby P, Sharp T, Hume S. Tyrosine-free amino acid mixture attenuates amphetamine-induced displacement of [11C]raclopride in striatum in vivo: A rat PET study. Synapse. 2004 Feb; 51(2):151-7.
14. Leyton M, Pun VK, Benkelfat C, Young SN. A new method for rapidly and simultaneously decreasing serotonin and catecholamine synthesis in humans. J Psychiatry Neurosci. 2003; 28(6):464-7.
15. Lyons PM, Truswell AS. Serotonin precursor influenced by type of carbohydrate meal in healthy adults. Am J of Clin Nut 1988; 47: 433-439
16. McCloughen A. The association between schizophrenia and cigarette smoking: a review of the literature and implications for mental health nursing practice. Int J Ment Health Nurs. 2003 Jun; 12(2):119-29.
17. Montgomery AJ, McTavish SF, Cowen PJ, Grasby PM. Reduction of brain dopamine concentration with dietary tyrosine plus phenylalanine depletion: an [11C]raclopride PET study. Am J Psychiatry. 2003 Oct; 160(10):1887-9.
18. Oduho GW, Han Y, and Baker DH. Iron deficiency reduces efficacy of triptophan as a niacin precursor. J. Nutr. 1994; 124(3):444-50.
19. O'Reilly R, Davis BA, Durden DA, Thorpe L, Machnee H, Boulton AA. Plasma phenylethylamine in schizophrenic patients. Biol Psychiatry. 1991; 30(2):145-50.
20. Peters JC, Harper AE. Influence of dietary protein level on protein self-selection and plasma and brain amino acid concentrations. Physiol Behav. 1984; 33(5):783-90.
21. Reilly JG, McTavish SF, Young AH. Rapid depletion of plasma tryptophan: a review of studies and experimental methodology. Psychopharmacol. 1997; 11(4):381-92.
22. Roberts SA, Thorpe JM, Ball RO, Pencharz PB. Tyrosine requirement of healthy men receiving a fixed phenylalanine intake determined by using indicator amino acid oxidation. Am J Clin Nutr. 2001; 73:276-282.
23. Rogers RD, Tunbridge EM, Bhagwagar Z, Drevets WC, Sahakian Bjand, Carter CS: Tryptophan Depletion Alters the Decision-Making of Healthy Volunteers through Altered Processing of Reward Cues. neuropsychopharmacology. 2003; 28: 153-162.
24. Rubinsztein JS, Rogers RD, Riedel WJ, Mehta MA, Robbins TW, Sahakian BJ. Acute dietary tryptophan depletion impairs maintenance of "affective set" and delayed visual recognition in healthy volunteers. psychopharmacology (Berl). 2001 Mar; 154(3):319-26
25. Scarna A, Gijsman HJ, McTavish SF, Harmer CJ, Cowen PJ, Goodwin GM. Effects of a branched-chain amino acid drink in mania. Br J Psychiatry. 2003; 182:210-3.
26. Schmeck K, Sadigorsky S, Englert E, Demisch L, Dierks T, Barta S, Poustka F. Mood changes following acute tryptophan depletion in healthy adults. Psychopathology. 2002 Jul-Aug; 35(4):234-40
27. Schott K, Schaefer JE, Richartz E, Batra A, Eusterschulte B, Klein R, Berg PA, Bartels M, Mann K, Buchkremer G. Autoantibodies to serotonin in serum of patients with psychiatric disorders. Psychiatry Res. 2003 Nov 1; 121(1):51-7.
28. Schultz SK, Ellingrod V, Fleming FW, Andreasen NC. The association between risk factors for tardive dyskinesia and phenylalanine-induced abnormal movements in schizophrenia. Hum Psychopharmacol. 2001 Apr; 16(3):273-277.
29. Strüder HK, Weicker H. Physiology and Pathophysiology of the Serotonergic System and its Implications on Mental and Physical Performance. Int J Sports Med 2001; 22: 467-497.
30. Strüder HK, Weicker H. Physiology and Pathophysiology of the Serotonergic System and its Implications on Mental and Physical Performance. Part II. Int J Sports Med. 2001; 22: 482-497.
31. Williams W, Shoaf SE, Hommer D, Rawlings R, Linnoila R. . Effects of Acute Tryptophan Depletion on Plasma and Cerebrospinal Fluid Tryptophan and 5-Hydroxyindoleacetic Acid in Normal Volunteers. J. Neurochem. 1999; 72 (4). 193-9.
32. Wirleitner B, Neurauter G, Schrocksnadel K, Frick B, Fuchs D. Interferon-gamma-induced conversion of tryptophan: immunologic and neuropsychiatric aspects. Curr Med Chem. 2003 Aug; 10(16):1581-91.
33. Wurtman RJ. Effects of foods on the brain. Possible implications for understanding and treating Tourette Syndrome. Advances in Neurology. 1992; 58:293-301
34. Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ. Effects of normal meals rich in carbohydrates or proteins on plasma tryptophan and tyrosine ratios. Am J Clin Nutr. 2003; 77(1):128-32
35. Young AH, Hughes JH, Marsh VR, Ashton CH. Acute tryptophan depletion attenuates auditory event related potentials in bipolar disorder: a preliminary study. J Affect Disord. 2002 May; 69(1-3):83-92.
36. Young SN, Teff KL. Tryptophan availability, 5HTP synthesis and 5HT function. Prog. Neuro Psychopharmacol and Biol Psyshiat. 1989. 13:373-79.
37. Young SN, Leyton M. The role of serotonin in human mood and social interaction. Insight from altered tryptophan levels. Pharmacol Biochem Behav. 2002 Apr; 71(4):857-65.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.

De genes aislados a redes multiómicas: revisión retrospectiva-longitudinal en trastornos neuropsiquiátricos (2000–2025)
Prof. Lic. Giselle Corti et. al
Fecha Publicación: 23/01/2026
La paradoja evolutiva de los HARs: cognición avanzada y riesgo de psicosis en Homo sapiens
Prof. Lic. Giselle Corti et. al
Fecha Publicación: 28/08/2025
Pensando la esquizofrenia
Pau Martínez Farrero
Fecha Publicación: 22/06/2025
Esquizofrenia resistente al tratamiento. A propósito de un caso.
Ana María Hamilton López et. al
Fecha Publicación: 18/05/2025
Diagnóstico diferencial y dificultades clínicas en el reconocimiento del Trastorno Esquizoafectivo
Carmen Regueiro Martín-Albo et. al
Fecha Publicación: 18/05/2025
Intervención basada en la Terapia de Aceptación y Compromiso en un primer episodio psicótico
Aarón Argudo Palacios
Fecha Publicación: 18/05/2025