Desde la publicación de la primera interacción genotipo-ambiente y comportamiento antisocial han pasado cinco años. Desde entonces, diversos estudios han intentado replicar la asociación entre la adversidad infantil y la monoaminooxidasa A y el comportamiento antisocial. En este trabajo revisaremos el estado de la cuestión y cúales son las últimas aportaciones desde las neurociencias experimentales, pasando por las aportaciones de la neurociencia social hasta los estudios que relacionan la activación del cingulado o la amígdala, o la hipoactivación de la corteza prefrontal con algunos comportamientos antisociales.
Una vez que se conocen bién los extremos, ¿cúales són los mecanismos mediante que regulan o moderan el efecto de la MAOA en el maltrato? La hipótesis que cuenta con más respaldo experimental es la disregulación del eje hipotálamo-pituitario-adrenal y los efectos que ello tiene en la maduración del sistema nervioso central, especialmente en la corteza prefrontal. Intentaremos también ofrecer una imagen integradora de las diferentes aproximaciones y de las implicaciones que pueda tener esta investigación en el conocimiento de la etiopatogenia del comportamiento antisocial y sus manifestaciones (trastorno antisocial de la personalidad, trastorno límite, etc).
Genética de la violencia: ¿Nacemos violentos o nos hacemos violentos?
Gallardo-Pujol, David; García-Forero, Carlos; Maydeu-Olivares, Alberto; Andrés-Pueyo, Antonio.
Departament de Personalitat, Avaluació i Tractament Psicològic. Facultat de psicología. Universidad de Barcelona
Resumen
Desde la publicación de la primera interacción genotipo-ambiente y comportamiento antisocial han pasado cinco años. Desde entonces, diversos estudios han intentado replicar la asociación entre la adversidad infantil y la monoaminooxidasa A y el comportamiento antisocial. En este trabajo revisaremos el estado de la cuestión y cúales son las últimas aportaciones desde las neurociencias experimentales, pasando por las aportaciones de la neurociencia social hasta los estudios que relacionan la activación del cingulado o la amígdala, o la hipoactivación de la corteza prefrontal con algunos comportamientos antisociales. Una vez que se conocen bién los extremos, ¿cúales són los mecanismos mediante que regulan o moderan el efecto de la MAOA en el maltrato? La hipótesis que cuenta con más respaldo experimental es la disregulación del eje hipotálamo-pituitario-adrenal y los efectos que ello tiene en la maduración del sistema nervioso central, especialmente en la corteza prefrontal. Intentaremos también ofrecer una imagen integradora de las diferentes aproximaciones y de las implicaciones que pueda tener esta investigación en el conocimiento de la etiopatogenia del comportamiento antisocial y sus manifestaciones (trastorno antisocial de la personalidad, trastorno límite, etc).
Introducción
En general, el comportamiento antisocial puede definirse como un patrón general de desprecio y violación de los derechos de los demás, que comienza en la infancia o el principio de la adolescencia y continúa en la edad adulta (1). El comportamiento antisocial engloba toda una serie de conceptos que abarcarían una revisión mucho más exhaustiva que la que pretendemos aquí, pero que incluyen diferentes tipos de agresión, robos, engaños, conductas impulsivas, ultrajes y violencia entre sus diferentes manifestaciones.
Todos estos comportamientos tienen graves consecuencias para nuestras sociedades. Por ejemplo, cada año hay más de 5, 4 millones de crímenes violentos en los Estados Unidos de América (2). En nuestro país, aunque las cifras no sean tan elevadas, hay una tasa de 0, 9 muertes por cien mil habitantes, amén de otros delitos violentos contra las personas o las propiedades. Esto ha llevado a la Organización Mundial de la Salud a considerar la violencia y sus manifestaciones como uno de los problemas de salud pública más apremiantes del planeta (3).
Conocer los mecanismos que causan este tipo de comportamientos debe permitir esclarecer su etiopatogénia, también la detección precoz de individuos con riesgo de presentar este comportamiento, y en consecuencia, poder ofrecer dianas de intervención terapéuticas.
El objetivo del presente trabajo es ofrecer una revisión sobre los conocimientos que tenemos a día de hoy acerca del desarrollo del comportamiento antisocial, y especialmente de la interacción entre factores ambientales y genéticos. Respecto a las bases genéticas del comportamiento antisocial, los estudios de genética cuantitativa nos informan de que alrededor del cincuenta por ciento de la variabilidad en la población de este comportamiento es debida a la variabilidad en los genes de esa población, así lo indican la mayoría de estudios en humanos (4). Estos datos apoyan la idea que una parte importante de la etiología del comportamiento está en los genes. Sin embargo, los esfuerzos realizados hasta ahora para encontrar genes concretos que tuvieran un gran efecto no han cubierto las expectativas generadas.
Entre estos, sin duda el caso más espectacular fue el hallazgo realizado por Brunner et al. (5), que encontraron que una mutación puntual en el gen de la monoaminooxidasa A (MAOA) parecía ser el responsable del comportamiento manifiestamente antisocial de los hombres de una familia holandesa. Esta mutación fue luego comprobada en ratones knock-out y los efectos eran los mismos (6). Estudios posteriores han sido incapaces de replicar este efecto tan grande, aunque sí que han replicado efectos menores (7).
Otros genes se han asociado también al comportamiento impulsivo, cómo por ejemplo el transportador de 5-HT (5-HTT). Este gen muestra dos alelos diferentes, uno corto y otro largo. El alelo corto del 5-HTT se ha asociado con niveles de expresión reducidos de 5-HTT en el cerebro, y en consecuencia con una recaptación insuficiente de 5-HT de la sinapsis (8) y con una respuesta exagerada al estrés (9, 10). Parece pues, que un buen funcionamiento del sistema serotoninérgico es imprescindible para un adecuado control de los impulsos (11, 12), y que varios los genes que forman parte de la regulación este sistema tienen un papel importante en comportamientos agresivos, violentos o impulsivos (13) (5-HTT, MAOA o el gen que codifica para la Triptófano Hidroxilasa 1, TPH1). En otros aspectos de la agresión, por ejemplo la que se da en la enfermedad de Alzheimer, se ha dado una relación entre los comportamientos agresivos y algunos genes del sistema dopaminérgico, en concreto el DRD1 (14).
En definitiva, los efectos de los genes en el comportamiento antisocial es moderado, pero incapaz de explicar por si sólo la variabilidad en el comportamiento antisocial. Por otro lado, y sin lugar a dudas, hay factores ambientales que son muy relevantes para explicar la etiología del comportamiento antisocial.
Factores ambientales
Para comprender el desarrollo de algunos rasgos asociados también con el comportamiento antisocial, cómo la agresividad, conviene entender el desarrollo natural de esta. Conviene pues, resaltar los estudios longitudinales llevados a cabo por el profesor Richard Tremblay, de la Universidad de Montreal (15). Estos estudios, iniciados en la década de los años setenta, pusieron de relieve que, en contra de la percepción habitual, la edad en la que los niños son más agresivos es entre el primer y cuarto año, y no durante la adolescencia (16). Sin embargo, es cuando los adolescentes empiezan a separarse de los padres y amplían el repertorio de amistades o compañías cuando estos intensifican la gravedad de aquéllos actos antisociales que puedan cometer (16). También en esta línea, la investigadora Cathy Spatz Widom fue la primera que aportó evidencias empíricas acerca del efecto de la adversidad ambiental sobre el desarrollo del comportamiento antisocial (17), rompiendo así el tópico que afirmaba que la violencia genera violencia. Hizo un seguimiento longitudinal de un grupo de chicos que habían sido víctimas de maltrato. Cabe mencionar que en todos los casos había una sentencia firme que así lo avalaba.
Aproximadamente, el haber sufrido algún tipo de maltrato infantil incrementaba en un 30% las posibilidades de ser maltratadores en edad adulta. Pero este ambiente adverso por si sólo era incapaz de explicar porqué unos niños se convertían en violentos y otros no. ¿Cuáles son pues, los factores que protegen o predisponen al comportamiento antisocial?
Interacciones entre genotipo y ambiente
Cunado intentamos responder la pregunta que nos acabamos de formular, surge otra cuestión: ¿Es posible que la diferente respuesta de algunos niños a la adversidad infantil esté en las diferencias individuales en el funcionamiento de su sistema nervioso? En el año 2002 empezó a resolverse esta cuestión, y de paso, la dicotomía entre genes y ambiente en el campo del comportamiento antisocial. Avshalom Caspi y Terrie E. Moffit, del Institute of Psychiatry de Londres, fueron los primeros en demostrar una relación directa entre el efecto del entorno en combinación con un gen particular, el de la MAOA, cuando estudiaron una población de chicos desde la infancia hasta la adultez(18). Hasta el momento, algunos estudios habían relacionado el gen de la MAOA con el comportamiento violento (5), y otros habían demostrado el efecto del maltrato infantil en el desarrollo del comportamiento antisocial (17, 19). Basándose en estos hallazgos, Caspi y sus colegas plantearon la hipótesis de que la MAOA podía moderar la influencia de la adversidad ambiental en los sistemas neurales implicados en el desarrollo del comportamiento antisocial. Para poner a prueba esta hipótesis utilizaron a los miembros del Dunedin Multidisciplinary Health and Development Study, una cohorte de 1037 individuos a la que han seguido durante más de treinta años. El uso de esta cohorte planteó tres ventajas importantes para este estudio. Por un lado, los participantes en el estudio representan a la población general. Por otro lado, la muestra tiene bien caracterizada la historia de adversidad ambiental de cada individuo. Y tercera, esta muestra también tiene caracterizadas de forma rigurosa las diferentes formas de comportamiento antisocial que protagonizaron sus miembros.
Entre los resultados que obtuvieron, destacan el hallazgo de interacciones significativas entre el gen de la MAOA y el grado de adversidad infantil cuando se estudiaba el trastorno de conducta entre los 10 y 18 años, cuando se estudiaba el número de arrestos y condenas a los 26 años, o bien cuando se estudiaban otras medidas cómo por ejemplo la disposición hacia la violencia, o bien síntomas del trastorno antisocial de la personalidad. Precisamente, todos los resultados iban en la misma línea. Aquellos individuos que portaban una versión poco funcional del gen de la MAOA y que habían sufrido maltrato severo, presentaban puntuaciones más proclives a la antisocialidad en todas las medidas analizadas. Pero, ¿qué entendemos por versión poco funcional de la MAOA? En la región promotora del gen de la MAOA, está bien documentada la existencia de un polimorfismo de un número variable de repeticiones en tándem (VNTR) que es conocido que afecta a la expresión de dicho gen. Cuando el número de repeticiones en esa región es de 3 o menos, el gen de la MAOA no se expresa adecuadamente. Por el contrario, cuando las repeticiones son 4 o más, dicho gen se expresa con toda su funcionalidad. Por ello son importantes las implicaciones de la funcionalidad de la MAOA en el desarrollo de los sistemas de neurotransmisión regulados por ella, cómo veremos más adelante, ya que un déficit crónico de MAOA puede provocar una hiperreactividad de los sistemas de neurotransmisión monoaminérgicos.
Este estudio representó un punto de inflexión en los estudios sobre desarrollo, especialmente porqué abrió el camino al estudio de diferentes factores de riesgo ambientales conocidos y de cómo estos interactúan con factores de riesgo genéticos también conocidos. En esta línea, este mismo grupo ha abierto el camino para la investigación de las interacciones entre sucesos vitales y el transportador de serotonina en la genésis de la depresión (20), o la interacción entre el gen de la Catecol-O-Metil Transferasa y el consumo de cannabis y síntomas psicóticos (21).
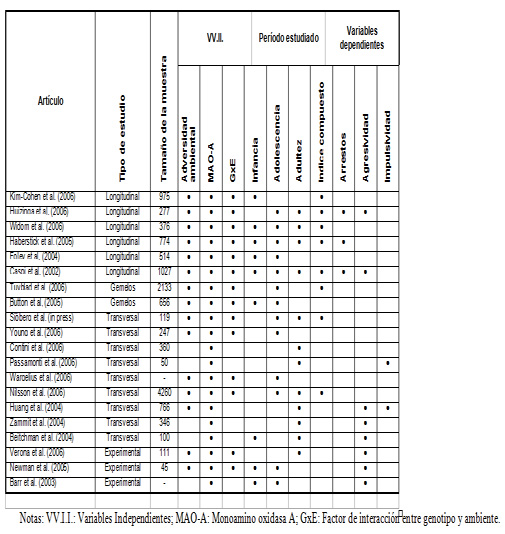
Después de este estudio seminal, ha habido diversos estudios que han reportado diferentes resultados respecto a los hallazgos originales, cómo se puede ver en la tabla 1. Por un lado, los hay que han replicado el efecto de la interacción en estudios longitudinales (22-24), en estudios de gemelos (25, 26), o en estudios transversales (27-31), incluso en primates (32), siendo en general el tamaño del efecto de la interacción moderado (r=0. 2) (22). Por otro lado, también hay estudios que no han conseguido replicar los hallazgos originales de Caspi y sus colegas, ya sea en estudios longitudinales (33, 34), o transversales (35). Esta disparidad puede ser debida a varios factores, como la composición de las muestras, o las propiedades de las medidas estudiadas. En general, y a raíz de lo que se observa en la literatura, se puede afirmar que la interacción parece sólida y consistente. Pese a ello, no faltan críticas al concepto de interacción genotipo-ambiente (36), afirmando que en algunos casos, esta interacción puede ser debida a artefactos estadísticos. Sin embargo, los autores de esta crítica publicaron un estudio (24) que ha sido criticado con posterioridad por sus debilidades estadísticas (37, 38). A pesar de las diferentes críticas, en nuestra opinión, la significación biológica de la interacción es relevante, ya que hay unos mecanismos biológicos subyacentes que pueden explicar la etiopatogénia del comportamiento antisocial, aunque sea a un nivel muy elemental (39).
Tabla 1. Resumen de los estudios acerca de las interacciones genotipo-ambiente y comportamiento antisocial
Perspectivas de la investigación
Cómo hemos visto, las interacciones genotipo-ambiente ocurren cuando el efecto de un patógeno ambiental en la salud de una persona es mediado por el genotipo de ésta. En el caso que nos ocupa, hemos visto cómo el efecto de la adversidad infantil es mediado por el gen de la MAOA.
Tanto la neurología cómo la psiquiatría han realizado ingentes esfuerzos hasta la fecha para encontrar genes que estuviesen directamente relacionados con diferentes patologías. Así, tanto la neurología como la psiquiatría pueden beneficiarse enormemente de la investigación en el campo de las interacciones genotipo-ambiente, produciendo éstas un gran efecto en la investigación en neurociencias.
Los trabajos que hemos presentado, a pesar de ser pioneros, tienen una gran limitación, y es que no tienen una cadena de inferencia causal robusta que sustente las relaciones entre genes, ambiente y comportamiento antisocial (40). Hay un gran salto conceptual entre la expresión eficiente del gen de la MAOA, cómo el ambiente modela la capacidad de respuesta de los sistemas de neurotransmisión monoaminérgicos y un comportamiento tan complejo cómo es el comportamiento antisocial. En este tipo de trabajos, por ejemplo, es muy difícil, por no decir imposible, controlar toda una serie de variables que pueden afectar estas relaciones. Sería ideal poder hacer estas comprobaciones en un laboratorio, pero este tipo de trabajos no se puede llevar a la práctica por tres razones (40): por los aspectos éticos que impiden exponer sujetos a situaciones que les conlleven algún riesgo; porqué los modelos animales no pueden ser igualados a los modelos humanos en conductas tan complejas; y tercero, porqué habitualmente el daño que pueden provocar patógenos ambientales reales se acumulan durante años, y en cambio dentro del laboratorio tienen una duración muy limitada.
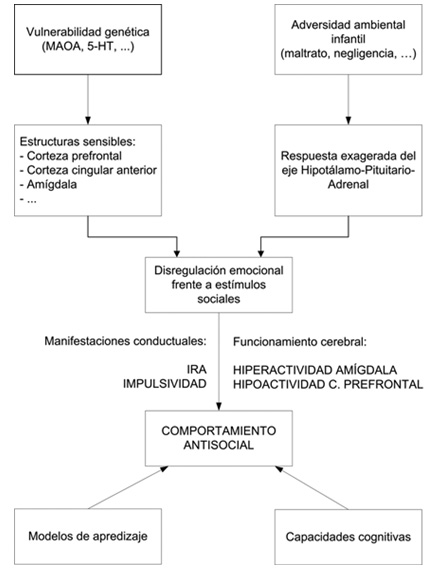
En este sentido, y para tratar de superar estas limitaciones, hay algunos trabajos pioneros que nos indican cual es el camino a seguir para comprender cómo funcionan todos estos mecanismos. Meyer-Lindenberg et al. (11) plantearon un interesante trabajo en el que estudiaron el cerebro a nivel estructural y funcional en función del genotipo de la MAOA y de diferentes características fenotípicas obtenidas a partir de tareas experimentales que podían ser considerados análogos de comportamientos violentos. Encontraron que el alelo que da como resultado una menor expresión de la MAOA (MAOA-L), asociado previamente con el riesgo a presentar conductas violentas, predecía una reducción del volumen límbico y una hiperresponsividad de la amígdala en una tarea de reconocimiento facial de emociones, juntamente con una reactividad disminuida de las regiones reguladoras prefrontales. En hombres, este mismo alelo también se asociaba a cambios en el volumen de la corteza orbitofrontal, a hiperreactividad en la amígdala y el hipocampo en una tarea de recuerdo aversivo y a una activación del cíngulo empeorada durante una tarea de inhibición cognitiva. En general, lo que reportan Meyer-Lindenberg y sus colegas son diferencias en la circuitería límbica para la regulación emocional y el control cognitivo que pueden estar implicadas en la asociación entre MAOA y comportamiento antisocial.
También en esta línea, Eisenberger et al. (41) exploraron cómo estaban asociados los alelos del gen de la MAOA con las puntuaciones en una escala de agresividad bien establecida (42, 43), y con la respuesta a un paradigma de exclusión social (44) en un paradigma de neuroimagen funcional. Así, los individuos MAOA-L se mostraron cómo más agresivos que los individuos MAOA-H, así cómo una hipersensibilidad interpersonal y una mayor actividad de la corteza cingulada anterior dorsal en relación a reacciones de exclusión social. Los autores sugieren que la MAOA puede estar relacionada con comportamientos agresivos mediante la hipersensibilidad emocional en contextos sociales. Aunque los resultados de este trabajo son muy interesantes, deben ser tomados con cautela, ya que el tamaño de la muestra es muy pequeño, y el trabajo tiene una serie de limitaciones experimentales (45, 46). Como vemos, estas estructuras son las mismas que veíamos al principio de este trabajo cuando hablábamos de las estructuras cerebrales implicadas tempranamente con el comportamiento antisocial.
Así pues, parece que la relación entre MAOA y comportamiento antisocial en los agresores vendría dada por una disregulación emocional, básicamente una hiperreactividad funcional, especialmente en el sistema límbico, y por una falta de control inhibitorio sobre ésta, a nivel prefrontal. Para explicar el comportamiento agresivo, estos hallazgos responden parcialmente a la pregunta de cómo funciona el cerebro del agresor, o de alguien que se comporta de forma antisocial. Pero aún queda una pregunta muy importante por contestar: ¿Cómo la adversidad ambiental modifica el cerebro de una víctima de maltratos para convertirla en alguien antisocial? Es decir, ¿cuáles son los mecanismos que en interacción con la MAOA pueden convertir a alguien en antisocial?
Aquí sin duda el eje hipotálamo-hipófiso-adrenal y la respuesta frente al estrés juegan un papel muy importante. De hecho, se ha comprobado en animales que la actividad cerebral en situaciones de estrés crónico, cómo el que se daría en casos de adversidad ambiental severa, provocan cambios en el funcionamiento del cerebro (47, 48). Situaciones de estrés crónico también pueden dar lugar a cambios en la mielinización o la conectividad neuronal, y otros cambios estructurales (49), precisamente en lugares que han sido asociados con el comportamiento agresivo, cómo son la corteza prefrontal, la corteza cingular anterior o la amígdala. También es bien conocido cómo factores ambientales pueden modular la respuesta al estrés, la regulación epigenética debida a varios factores ambientales o el volumen hipocampal, que hemos visto más arriba que también está implicado en el comportamiento agresivo (50-52).
Así, a la vista de la literatura, se puede afirmar que tenemos un conocimiento parcial del problema y con evidencias escasas. Conocemos la interacción entre genes y ambiente en el desarrollo del comportamiento antisocial, pero tenemos pocos indicios acerca de los mecanismos que nos llevan desde la expresión del gen de la MAOA y la influencia del ambiente hostil durante el desarrollo hasta el comportamiento antisocial. Sin duda, en el futuro debemos esperar el desarrollo de estudios en el campo de las neurociencias cognitivas (40) que nos confirmen de forma causal el efecto del gen de la MAOA sobre el comportamiento antisocial, así cómo del efecto de la adversidad ambiental, y estudiar los circuitos que se pueden ver afectados de forma conjunta.
A medida que se vayan conociendo cada vez más datos acerca del desarrollo del comportamiento antisocial, será posible implementar programas de detección precoz de individuos en riesgo (p. ej. , intervenir intensamente en chicos que te tengan la versión MAOA-L del gen de la MAOA y que hayan estado expuestos a ambientes de riesgo, poco estructurados, con varios acontecimientos vitales estresantes). A nivel terapéutico de las manifestaciones del comportamiento antisocial, será especialmente útil la adecuación del tratamiento farmacológico a la etiopatogénia del trastorno. En este sentido, el uso de fármacos cómo el citalopram en el tratamiento de la agresión impulsiva parece especialmente adecuado. Sin embargo, debe avanzarse en dos frentes. El primero, hacia la farmacogenómica, es decir, administrar un tratamiento u otro en función de las características genéticas del paciente, cómo en el caso del cáncer(53). El segundo frente debe pasar un abordaje psicoterapéutico eficaz y que incluya programas de intervención cognitivo-conductuales, cómo por ejemplo los que se utilizan en el tratamiento de los agresores sexuales(54). De hecho, tanto los avances en neurociencias, cómo en la psicología del desarrollo que hemos expuesto en este trabajo forman parte de la agenda de investigación para el DSM-V(55), así como la consideración de los modelos dimensionales de la personalidad cómo útiles para el diagnóstico y la evaluación del tratamiento. Sólo con este abordaje integral podremos hacer frente a un problema con unas consecuencias tan graves como es el comportamiento antisocial.
Referencias
1. American Psychiatric Association, Diagnostic and statistical manual of mental disorders. (DSM-IV-TR). 2000, Washington, D. C. : American Psychiatric Association.
2. Statistics, U. S. B. o. J. , Criminal victimization. 2006, Washington, DC: Author.
3. Krug, E. G. , et al. , World report on violence and health. 2002, Geneva: World Health Organization,
4. Moffitt, T. E. , Genetic and Environmental Influences on Antisocial Behaviors: Evidence from Behavioral-Genetic Research. Adv Genet, 2005. Volume 55: p. 41-104.
5. Brunner, H. G. , et al. , Abnormal behavior associated with a point mutation in the structural gene for monoamine oxidase A. Science, 1993. 262(5133): p. 578-580.
6. Cases, O. , et al. , Aggressive behavior and altered amounts of brain serotonin and norepinephrine in mice lacking MAOA. Science, 1995. 268(5218): p. 1763-1766.
7. Passamonti, L. , et al. , Monoamine Oxidase-A Genetic Variations Influence Brain Activity Associated with Inhibitory Control: New Insight into the Neural Correlates of Impulsivity. Biol Psychiatry, 2006. 59(4): p. 334-340.
8. Greenberg, B. D. , et al. , Genetic variation in the serotonin transporter promoter region affects serotonin uptake in human blood platelets. Am J Medical Genet, 1999. 88(1): p. 83-87.
9. Barr, C. S. , et al. , Rearing condition and rh5-HTTLPR interact to influence limbic-hypothalamic-pituitary-adrenal axis response to stress in infant macaques. Biol Psychiatry, 2004. 55(7): p. 733-738.
10. Canli, T. , et al. , Neural correlates of epigenesis. Proc Natl Acad Sci U S A, 2006. 103(43): p. 16033-16038.
11. Meyer-Lindenberg, A. , et al. , Neural mechanisms of genetic risk for impulsivity and violence in humans. Proc Natl Acad Sci U S A, 2006. 103(16): p. 6269-6274.
12. Coccaro, E. F. , Central Serotonin and Impulsive Aggression. Br J Psychiatry, 1989. 155: p. 52-62.
13. Bondy, B. , A. Buettner, and P. Zill, Genetics of suicide. Mol Psychiatry, 2006. 11(4): p. 336-351.
14. Holmes, C. , et al. , Psychosis and aggression in Alzheimer's disease: the effect of dopamine receptor gene variation. Journal of Neurology Neurosurgery and Psychiatry, 2001. 71(6): p. 777-779.
15. Tremblay, R. E. , et al. , Predicting early onset of male antisocial behavior from preschool behavior. Arch gen Psychiatry, 1994. 51(9): p. 732-739.
16. Tremblay, R. E. , The development of aggressive behaviour during childhood: What have we learned in the past century? Int J Behav Dev, 2000. 24(2): p. 129-141.
17. Widom, C. S. , The cycle of violence. Science, 1989. 244(4901): p. 160-166.
18. Caspi, A. , et al. , Role of Genotype in the Cycle of Violence in Maltreated Children. Science, 2002. 297(5582): p. 851-854.
19. Widom, C. S. , Does Violence Beget Violence? A Critical Examination of the Literature. Psychol Bull, 1989. 106(1): p. 3-28.
20. Caspi, A. , et al. , Influence of Life Stress on Depression: Moderation by a Polymorphism in the 5-HTT Gene. Science, 2003. 301(5631): p. 386-389.
21. Caspi, A. , et al. , Moderation of the Effect of Adolescent-Onset cannabis Use on Adult Psychosis by a Functional Polymorphism in the Catechol-O-Methyltransferase Gene: Longitudinal Evidence of a Gene X Environment Interaction. Biol Psychiatry, 2005. 57(10): p. 1117-1127.
22. Kim-Cohen, J. , et al. , MAOA, maltreatment, and gene-environment interaction predicting children's mental health: new evidence and a meta-analysis. Mol Psychiatry, 2006. 11(10): p. 903-913.
23. Widom, C. S. and L. M. Brzustowicz, MAOA and the "Cycle of Violence:" Childhood Abuse and Neglect, MAOA Genotype, and Risk for Violent and Antisocial Behavior. Biol Psychiatry, 2006. 60(7): p. 684-689.
24. Foley, D. L. , et al. , Childhood adversity, monoamine oxidase a genotype, and risk for conduct disorder. Arch gen Psychiatry, 2004. 61(7): p. 738-44.
25. Tuvblad, C. , M. Grann, and P. Lichtenstein, Heritability for adolescent antisocial behavior differs with socioeconomic status: gene-environment interaction. J Child Psychol Psychiatry, 2006. 47(7): p. 734-743.
26. Button, T. M. M. , et al. , Family Dysfunction Interacts with Genes in the Causation of Antisocial Symptoms. Behavior Genetics, 2005. V35(2): p. 115-120.
27. Sjöberg, R. L. , et al. , Adolescent girls and criminal activity: Role of MAOA-LPR genotype and psychosocial factors. Am J Med Genet B, in press.
28. Wargelius, H. -L. , et al. , MAO-A genotype interaction with environment (psychosocial factors) and risk for criminality and alcohol related problems. Eur Neuropsychopharmacol, 2005. 15(Suppl. ): p. S325-S325.
29. Nilsson, K. W. , et al. , Role of Monoamine Oxidase A Genotype and Psychosocial Factors in Male Adolescent Criminal Activity. Biol Psychiatry, 2006. 59(2): p. 121-127.
30. Huang, Y. -y. , et al. , An Association between a Functional Polymorphism in the Monoamine Oxidase A Gene Promoter, Impulsive Traits and Early Abuse Experiences. neuropsychopharmacology, 2004. 29: p. 1498-1505.
31. Verona, E. , et al. , Gender specific gene-environment interactions on laboratory-assessed aggression. Biol Psychol, 2006. 71(1): p. 33-41.
32. Newman, T. K. , et al. , Monoamine oxidase A gene promoter variation and rearing experience influences aggressive behavior in rhesus monkeys. Biol Psychiatry, 2005. 57(2): p. 167-172.
33. Huizinga, D. , et al. , Childhood Maltreatment, Subsequent Antisocial Behavior, and the Role of Monoamine Oxidase A Genotype. Biol Psychiatry, 2006. 60(7): p. 677-683.
34. Haberstick, B. C. , et al. , Monoamine oxidase A (MAOA) and antisocial behaviors in the presence of childhood and adolescent maltreatment. Am J Med Genet B, 2005. 135B(1): p. 59-64.
35. Young, S. E. , et al. , Interaction Between MAO-A Genotype and Maltreatment in the Risk for Conduct Disorder: Failure to Confirm in Adolescent Patients. Am J Psychiatry, 2006. 163(6): p. 1019-1025.
36. Eaves, L. J. , Genotype Environment Interaction in Psychopathology: Fact or Artifact? Twin Res Hum Genet, 2006. 9: p. 1-8.
37. Joober, R. , S. Sengupta, and N. Schmitz, Promoting Measured Genes and Measured Environments: On the Importance of Careful Statistical Analyses and Biological Relevance. Arch gen Psychiatry, 2007. 64(3): p. 377-378.
38. Foley, D. and B. Riley, Promoting Measured Genes and Measured Environments: On the Importance of Careful Statistical Analyses and Biological Relevance--Reply. Arch gen Psychiatry, 2007. 64(3): p. 378.
39. Moffitt, T. E. , A. Caspi, and M. Rutter, Strategy for Investigating Interactions Between Measured Genes and Measured Environments. Arch gen Psychiatry, 2005. 62(5): p. 473-481.
40. Caspi, A. and T. E. Moffitt, Gene-environment interactions in psychiatry: joining forces with neuroscience. Nat Rev Neurosci, 2006. 7(7): p. 583-590.
41. Eisenberger, N. I. , et al. , Understanding Genetic Risk for Aggression: Clues From the Brain's Response to Social Exclusion. Biol Psychiatry, 2007. 61(9): p. 1100-1108.
42. Buss, A. H. and M. Perry, The Aggression Questionnaire. J Pers Soc Psychol, 1992. 63(3): p. 452-459.
43. Gallardo-Pujol, D. , et al. , Assessing aggressiveness quickly and efficiently: the Spanish adaptation of Aggression Questionnaire-Refined version. Eur Psychiatry, 2006. 21(7): p. 487-494.
44. Williams, K. D. and B. Jarvis, Cyberball: A program for use in research on interpersonal ostracism and acceptance. Behav Res Methods, 2006. 38(1): p. 174-180.
45. Eisenberger, N. I. , et al. , Monoamine Oxidase A, Gender Differences, and Social Exclusion: Response to Gallardo-Pujol et al. Biol Psychiatry, 2008. 63(2): p. e11.
46. Gallardo-Pujol, D. , et al. , Monoamine Oxidase A, Gender Differences, and Social Exclusion: Comment on "Eisenberger et al. " Biol Psychiatry, 2008. 63(2): p. e9-e10.
47. Martinez, M. , A. Calvo-Torrent, and J. Herbert, Mapping Brain Response to Social Stress in Rodents With c-fos Expression: A Review. Stress, 2002. 5(1): p. 3 - 13.
48. Martinez, M. , A. Calvo-Torrent, and M. -A. Pico-Alfonso, Social defeat and subordination as models of social stress in laboratory rodents: A review. Aggress Behav, 1998. 24(4): p. 241-256.
49. De Bellis, M. D. , The psychobiology of neglect. Child Maltreat, 2005. 10(2): p. 150-172.
50. Buss, C. , et al. , Maternal Care Modulates the Relationship between Prenatal Risk and Hippocampal Volume in Women But Not in Men. J Neurosci, 2007. 27(10): p. 2592-2595.
51. Meaney, M. J. , M. Szyf, and J. R. Seckl, Epigenetic mechanisms of perinatal programming of hypothalamic-pituitary-adrenal function and health. Trends Mol Med, 2007. 13(7): p. 269-277.
52. Seckl, J. R. and M. J. Meaney, Glucocorticoid "Programming" and PTSD Risk. Ann N Y Acad Sci, 2006. 1071(1): p. 351-378.
53. Easton, D. F. , et al. , Genome-wide association study identifies novel breast cancer susceptibility loci. Nature, 2007. 447(7148): p. 1087-1093.
54. Redondo-Illescas, S. , Manual para el tratamiento psicológico de los delincuentes. 2007, Madrid: Ediciones Pirámide.
55. Kupfer, D. J. , M. B. First, and D. A. Regier, A Research Agenda for DSM-V. 2005, Washington, DC: American Psychiatric Association.
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.
Plan UNO
Marisa Narváez
Fecha Publicación: 20/09/2025
Tratamientos no Farmacologicos del Dolor Cronico. Actualizacion y puesta al dia
Fernando Martínez Pintor
Fecha Publicación: 18/05/2025
Trastornos psiquiátricos en los conflictos armados actuales
María del Pilar Esquivel Hernández et. al
Fecha Publicación: 18/05/2025
Burn out en los cuidadores: bases neurocientíficas de su sintomatología
Ana María Martorella
Fecha Publicación: 20/05/2024
Uso problemático de pornografía y victimización sexual online en adolescentes
Enrique Normand de Pascual et. al
Fecha Publicación: 20/05/2024
Violencia y enfermedad mental. Responsabilidad del profesional sanitario.
JOSE CARLOS FUERTES ROCAÑIN
Fecha Publicación: 20/05/2024