Introducción: Los niños con (TDAH) pueden presentar una alta prevalencia de comorbilidad con trastornos de sueño. La naturaleza exacta de estos, están por determinarse.
Objetivos: Describir los trastornos del sueño encontrados por PSG en una muestra de 10 niños con (TDAH) del tipo hiperactivo-impulsivo.
Pacientes y métodos: Estudiamos 10 niños (1 femenino y 9 masculinos) con media de edad de 9, 30 años y DS de 4, 498148, con criterios según el DSM-IV de (TDAH) del tipo hiperactivo-impulsivo. Fueron evaluados por PSG y una exploración neurológica.
Resultados: Los estudios fueron anormales, 7 (70%) de los niños presentaron síndrome de movimientos periódicos durante el sueño (SMPS). La arquitectura del sueño de 8 (80%) de ellos mostró un incremento del porcentaje de fase III y disminución de la fase II de sueño lento. La latencia de REM estaba aumentada en 7 (70%), y el porciento de REM disminuido en 5 para un (50%). Se observaron paroxismos epileptiformes en el 40% de los niños con TDAH del tipo hiperactivo-impulsivo y en 4 del total de la muestra las declaraciones de parasomnias fueron demostradas.
Conclusiones: El incremento en la fase III puede estar relacionado con alteraciones de la transmisión de noradrenalina y dopamina presente en el TDAH. Existe en ellos una región del cerebro con intensa actividad epileptiforme que no llega a provocar crisis pero puede estar relacionada con los trastornos de conducta.
Estudio polisomnográfico nocturno (PSG) en una muestra de niños con déficit de atención con hiperactividad (TDAH), del tipo impulsivo-hiperactivo.
Yulizen Alfonso de Armas; Trinidad Virues Alba; Maria del Carme Rodriguez Bowra; José Antonio Galla Vazquez.
Centro de neurociencias de Cuba.
Resumen
Introducción: Los niños con (TDAH) pueden presentar una alta prevalencia de comorbilidad con trastornos de sueño. La naturaleza exacta de estos, están por determinarse.
Objetivos: Describir los trastornos del sueño encontrados por PSG en una muestra de 10 niños con (TDAH) del tipo hiperactivo-impulsivo.
Pacientes y métodos: Estudiamos 10 niños (1 femenino y 9 masculinos) con media de edad de 9, 30 años y DS de 4, 498148, con criterios según el DSM-IV de (TDAH) del tipo hiperactivo-impulsivo. Fueron evaluados por PSG y una exploración neurológica.
Resultados: Los estudios fueron anormales, 7 (70%) de los niños presentaron síndrome de movimientos periódicos durante el sueño (SMPS). La arquitectura del sueño de 8 (80%) de ellos mostró un incremento del porcentaje de fase III y disminución de la fase II de sueño lento. La latencia de REM estaba aumentada en 7 (70%), y el porciento de REM disminuido en 5 para un (50%). Se observaron paroxismos epileptiformes en el 40% de los niños con TDAH del tipo hiperactivo-impulsivo y en 4 del total de la muestra las declaraciones de parasomnias fueron demostradas.
Conclusiones: El incremento en la fase III puede estar relacionado con alteraciones de la transmisión de noradrenalina y dopamina presente en el TDAH. Existe en ellos una región del cerebro con intensa actividad epileptiforme que no llega a provocar crisis pero puede estar relacionada con los trastornos de conducta.
El sueño como una función biológica, es una situación fisiológica de desconexión reversible y parcialmente arreactiva al medio externo regulada de forma circadiana, está muy bien estructurada y reconocida en las últimas décadas por los avances en la medicina del sueño. Las funciones de los ciclos sueño vigilia han sido ampliamente estudiados desde el punto de vista neurofisiológico, bioquímico, molecular y genético, lo cual ha abierto el conocimiento acerca de los circuitos que están involucrados en esta función cerebral. Los diferentes neurotransmisores comprometidos en el paso de la vigilia al sueño, del sueño de movimientos oculares rápidos (mor) o (REM por sus siglas en inglés rapid eyes movements, ) al no MOR o NREM, y el regreso al despertar; están también relacionados con el trastorno por Déficit de atención con hiperactividad (TDAH), estos son: la dopamina, serotonina y noradrenalina. Por estas razones es que se supone una íntima relación entre TDAH y algunos trastornos del sueño.
La necesidad de dormir parece estar mediada por sustancias como la adenosina (también la interleucina- 1 y la prostaglandina D2), que se acumula en el cerebro de forma proporcional al tiempo pasado en vigilia y cuya presencia en el espacio extracelular del hipotálamo o del tronco cerebral es capaz de inhibir las neuronas implicadas en el mantenimiento de la vigilia e inducir el sueño. (1)
Electrofisiología del sueño
Aunque externamente la conducta del individuo dormido es muy similar durante todo el período de sueño, el cerebro sufre una importante serie de cambios, que pueden reconocerse mediante técnicas electrofisiológicas como la polisomnografía (PSG).
El registro de la actividad eléctrica cerebral (EEG), de los movimientos oculares (EOG) y del electromiograma del mentón (EMG) durante el sueño se conoce como polisomnografía. Esta técnica permite delimitar diversos patrones electrofisiológicos, conocidos como fases o estadios de sueño, que han demostrado ser clínicamente relevantes.
Durante el adormecimiento y el sueño superficial se registra en el EEG, en primer lugar, una actividad difusa a 4-7 her- zios y de amplitud moderada (fase I). Después aparece la fase II, con los husos de sueño (el marcador electrofisiológico de la interrupción a nivel del tálamo de la transmisión sensorial desde el exterior a la corteza) y los complejos K. Los movimientos oculares son lentos, habitualmente horizontales y desconjugados, de mayor amplitud en la fase I que en la II, y el tono muscular en el mentón está conservado.
Estas dos fases se presentan al inicio del sueño y tras unos 20 o 30 minutos. A medida que la profundidad del sueño aumenta se registran las fases III y IV, en las que la actividad del EEG consiste en ondas delta (de 1-3 herzios), de amplitud elevada, que ocupan al menos el 20% (fase III) y el 50% o más en la (fase IV) de la unidad de análisis (epoch). En estas fases no hay movimientos oculares perceptibles y el tono muscular, medido por el EMG del mentón, aunque disminuido, continúa presente.
Aproximadamente 90 minutos tras el inicio del sueño aparece el sueño REM, caracterizado por un EEG de baja a moderada amplitud, con frecuencias de 3-7 herzios, más similar a la fase I o la vigilia que a las fases II, III o IV, con movimientos oculares rápidos (REM) similares a los de una persona despierta, pero con una atonía completa en el EMG en todos los músculos voluntarios, excepto en el diafragma. Esta fase se conoce también como sueño paradójico, porque reúne características típicas de la vigilia o del sueño superficial, a pesar de que la persona está bien dormida.
La respiración, el ritmo cardíaco y la tensión arterial son regulares en las fases I a IV, pero se hacen irregulares en intensidad y frecuencia en la fase REM. Además, el control de la temperatura, que es homeotermo en la vigilia y en las fases I a IV, se hace poiquilotermo en la fase REM. Los sueños más vívidos y de contenido abigarrado e irreal se producen en la fase REM, mientras que en las fases II a IV son más simples, con un contenido parecido al de la vigilia y de menor longitud. (2). Debido a estas diferencias tan llamativas, el sueño suele dividirse en dos tipos básicos: sueño REM, que representa un 20 a 25% de la noche, y sueño NREM, que incluye las Fases I, II, III y IV. Las fases III y IV suelen designarse a veces como sueño lento, sueño profundo NREM o sueño de ondas lentas. Un adulto joven presenta un ciclo completo NREM-REM cada 90 minutos. En una noche normal se registran unos 5 ciclos de sueño, con mayor presencia de sueño profundo NREM al principio de la noche y mayor de fases II y REM al final de la misma.
Las descripciones electrofisiológicas del sueño REM y NREM parecen implicar que es todo el cerebro el que se encuentra, de manera uniforme, en un estado de actividad u otro, sin variaciones regionales. Sin embargo, estudios realizados con PET han demostrado diferencias importantes entre las áreas cerebrales en cada estadio (3, 4). En el sueño NREM se produce una profunda hipoactividad cerebral, pero con algunas diferencias. Así, las áreas sensoriales primarias parecen mantener mayor actividad que el resto, mientras que las áreas del córtex heteromodal o de asociación son las que sufren la desactivación más importante.
En el sueño REM, en cambio, hay una activación intensa de la amígdala, el hipocampo y el córtex frontal parasagital (girus zinguli), es decir, de las áreas cerebrales implicadas en la memoria y las emociones, así como en el tegmento pontino y el tálamo y, en menor grado, en el córtex de asociación visual unimodal.
Por el contrario, continúan profundamente desactivadas las áreas del córtex asociativo, lo que puede constituir la base del contenido irreal, emotivo e ilógico de los sueños en fase REM (5).
Sustrato neuroanatómico del ciclo vigilia-sueño
Los mecanismos neurofisiológicos que inducen los estados de vigilia tienen su sustrato anatómico en el sistema reticular activador ascendente (SRAA). Allí se encuentra el locus cerúleos, localizado en el piso del cuarto ventrículo, cuyas células se interconectan, hacia arriba, con la mayor parte de la corteza cerebral y, hacia abajo, en forma difusa con el tronco cerebral. Este pequeño núcleo gris central funciona como una lámpara, que la hace encender y apagar según la presencia de oscilaciones circadianas, con ciclos infradianos de aproximadamente dos horas de duración (2, 6). El locus cerúleos tiene un ritmo circadiano, el cual se correlaciona bastante bien con la curva de temperatura corporal central (CTCC) (7, 8) Es decir, cuando aumenta la temperatura, el locus cerúleo aumenta su actividad metabólica para producir mayor cantidad de catecolaminas y lo contrario. Lo anterior ayuda a inducir estados de menor o mayor alerta.
Por otra parte, el sistema inductor del sueño tiene su asiento en los núcleos grises posteriores del tronco cerebral. Estos núcleos se conectan con gran parte de la corteza cerebral y con el haz medial frontal. Por medio de este sustrato neuroanatómico se induce el sueño (9, 10). Aquí tienen papel central los núcleos grises del rafé dorsal secretores de serotonina y el núcleo giganto-celular de la formación reticular productor de acetilcolina (11, 12).
Sin embargo, gracias a la información obtenida mediante lesiones estructurales, registros neuronales y estudios de las conexiones entre diversos núcleos y de los sistemas de neurotransmisión del tronco, el tálamo, el córtex y el hipotálamo se ha podido detallar con más precisión como se organizan el sueño y la vigilia (13). Una de las áreas cerebrales más implicadas en su regulación es el hipotálamo, pero el tronco cerebral y el tálamo también son básicos. El núcleo preóptico-ventrolateral (VLPO), un grupo nuclear situado en el hipotálamo lateral anterior, parece ser el responsable de la iniciación del sueño. Esta zona y sus alrededores es el único lugar del cerebro en el que se incrementa la actividad neuronal tanto en el momento de iniciarse el sueño como después, mientras que está inactiva en vigilia. Las neuronas del complejo nuclear VLPO son inhibidoras, utilizan ácido gamma-aminobutírico (GABA) y galanina como neurotransmisores y están conectadas, directa o indirectamente de forma recíproca (14), con los principales núcleos del tronco, el cerebro anterior basal (basal forebrain o BF) y el hipotálamo implicados en el mantenimiento de la vigilia: locus coeruleus (LC), rafe dorsal (RD), núcleo tuberomamilar (TM), núcleos colinérgicos del cerebro anterior basal (BF) y del tegmento pedúnculo-pontino y laterodorsal (PPT/LDT) y, probablemente, hipocretinérgico (Hcrt). Todos estos grupos nucleares, cada uno con un sistema neurotransmisor específico (noradrenalina, serotonina, histamina, acetilcolina e hipocretina, respectivamente), tienen una importante y característica actividad en vigilia, que disminuye al pasar al sueño NREM y que llega al mínimo durante el sueño REM (con la excepción notable de los núcleos colinérgicos BF y PPT/LDT, que presentan de nuevo una gran actividad en fase REM).
El tegmento de la protuberancia contiene las estructuras críticas para la generación del sueño REM, pero otras estructuras, como la parte adyacente al núcleo VLPO del hipotálamo, también modulan su aparición. Durante el sueño REM se produce una inhibición máxima de los sistemas aminérgicos (LC y RD) del tronco, junto con una gran actividad en el sistema colinérgico del tronco (PPT/LDT).
El progresivo silenciamiento monoaminérgico que ocurre poco antes y durante el sueño REM desinhibe los núcleos colinérgicos y da lugar, por un lado, a la activación de un sistema inhibidor del tono muscular en la formación reticular bulbar, que produce la parálisis de la musculatura estriada voluntaria (excepto el diafragma) y, por otro, a la activación talamocortical, con desincronización del EEG y descargas ponto-genículo-occipitales (PGO waves) asociadas a los movimientos oculares rápidos (REM) típicos de esta fase. El área esencial que desencadena y coordina todos los componentes del sueño REM parece estar en la parte anterior del núcleo reticularis ponéis oralis desinhibe los núcleos colinérgicos y da lugar, por un lado, a la activación de un sistema inhibidor del tono muscular en la formación reticular bulbar, que produce la parálisis de la musculatura estriada voluntaria (excepto el diafragma) y, por otro, a la activación talamocortical, con desincronización del EEG y descargas ponto-genículo-occipitales (PGO waves) asociadas a los movimientos oculares rápidos (REM) típicos de esta fase. El área esencial que desencadena y coordina todos los componentes del sueño REM parece estar en la parte anterior del núcleo reticularis ponéis oralis (15)
El sistema hipocretina/orexina es un sistema neurotransmisor excitatorio recientemente descubierto. Sus neuronas se localizan en el hipotálamo posterior, cerca del fórnix, y conectan con los principales núcleos implicados en el control del sueño y la vigilia, así como con la corteza cerebral (16). La destrucción de estas neuronas y la disminución en la transmisión hipocretinérgica es la causa de la mayoría de los casos de narcolepsia humana. Se desconoce el grado de afectación de este sistema, por ejemplo, en la enfermedad de Parkinson, aunque estudios preliminares sugieren que es normal (17).
Clasificación de las alteraciones del sueño
Las alteraciones del sueño son tan diversas y su prevalencia tan elevada (puede ser mayor del 30% en niños y adultos e incluso superior en ancianos), que se ha impuesto la necesidad de establecer una clasificación sistemática que las contemple y trate a todas.
La clasificación más usada y difundida en la actualidad es la clasificación Internacional de los Trastornos del sueño (CITS), creada en 1990 (18), la cual fue revisada en 1997 con la introducción de mínimos cambios (19), y desplazó la clasificación más empleada hasta entonces, La clasificación Diagnóstica de los Trastornos del sueño y de la vigilia, publicada por la Sociedad Americana de Trastornos del sueño, en 1979 (20).
La CITS se creo con fines diagnósticos y epidemiológicos, y especifica criterios diagnósticos y permite indexar cada alteración de sueño con un código determinado, lo que facilita las tareas, tanto clínicas como científicas. Hay listados en la actualidad 84 trastornos del sueño agrupados en 4 categorías (18, 21)
Disomnias: Incluyen las alteraciones cuya manifestación es el insomnio o la hipersomnia. A su vez se subdividen en: Intrínsecas, que manifiestan una enfermedad interna; extrínsecas por estímulo nociceptivo, y por alteración del ritmo circadiano.
Parasomnias: Agrupan los fenómenos intrusivos del sueño, sin queja primaria de sueño excesivo o insuficiente. Se subdividen en:
· Alteraciones del despertar · Trastornos de la transición sueño vigilia · Parasomnias asociadas al sueño REM · Otras parasomnias.
Trastornos por patología médica o psiquiátrica: Engloban las alteraciones del sueño o de la vigilia, secundaria a un trastorno de naturaleza orgánica reconocida o funcional psiquiátrica. Se establecen los siguientes subgrupos:
· Asociados a trastornos mentales · Asociados a alteraciones neurológicas · Asociados a otras alteraciones médicas
Trastornos propuestos: Completan aquellas alteraciones aún en estudio o de naturaleza conflictiva para su clasificación, en la actualidad, en una de las anteriores categorías.
Efectos neurocognitivos de los problemas del sueño
El sueño desde el punto de vista ontogénico se va modificando desde el nacimiento, hasta la vida adulta, Las necesidades de sueño van siendo diferentes con el paso de los años. El sueño REM por ejemplo en la neurobiología del neurodesarrollo tiene una crucial importancia dada en la relación con la mielinización, con la presencia de aumento de sinapsis a nivel neuronal, de manera que las alteraciones del sueño en las primeras etapas de la vida, pueden ser trascendentes en el desarrollo del niño. Existe una estrecha relación entre los trastornos del sueño y la conducta diurna (22)
Ya se ha demostrado claramente que tanto la falta de sueño como la interrupción del sueño, o “fragmentación del sueño”, tienen un efecto perjudicial sobre el desarrollo neurocognitivo de los niños. Se han comunicado deficiencias académicas y problemas de aprendizaje y memoria en numerosos estudios realizados en niños, por ejemplo, con síndrome de Apnea Obstructiva durante el sueño (SAOS). Asimismo, cada vez más se comunican conductas hiperactivas, negativas y de desatención, parecidas a las halladas en el TDAH, en niños que roncan o tienen SAOS. Se observan cambios de conducta similares en algunos niños con síndrome de Movimientos Periódicos de las Piernas (PLMD, por su sigla en inglés) y síndrome de las Piernas Inquietas (RLS, por su sigla en inglés). Se sabe que estos trastornos provocan la fragmentación del sueño debido a que la persona se despierta a causa de los movimientos de las piernas y los episodios de alteración respiratoria. También se ha sugerido que los niños que se despiertan con más frecuencia en respuesta al movimiento de sus piernas manifiestan síntomas más graves del TDAH que los niños que duermen sin interrupciones. Esto sugiere que existe un mecanismo para los cambios cognitivos y conductuales en las disomnias infantiles. Un sueño insuficiente puede contribuir a una disfunción cortical y a una alteración de las funciones ejecutivas tales como el autocontrol, la regulación emocional y la memoria de trabajo, de lo cual es responsable la corteza prefrontal y por lo tanto promueve conductas características de los niños diagnosticados con TDAH.
La prevalencia del insomnio infantil se calcula aproximadamente del 1% al 6% entre la población pediátrica general y mucho más elevada entre los niños con enfermedades médicas crónicas, enfermedades psiquiátricas y del desarrollo neurológico. Cuando hay resistencia para dormir e intermitencia del sueño durante la noche, la prevalencia del comportamiento de interrupción del sueño alcanza del 25% al 50% de los niños en edad preescolar. En la mayoría de los casos de insomnio, el tratamiento correcto consiste en una cura de sueño adecuada, si bien en algunos casos, se justifican enfoques conductistas y medicación.
Además de medidas cognitivo-conductuales seguidas en el TDAH, las medicaciones también han sido utilizadas; éstas también pueden afectar el sueño.
Clínica del TDAH
El TDAH tiene su inicio en la infancia temprana y cursa con un patrón persistente de inatención y/o hiperactividad-impulsividad más frecuente y grave que el observado habitualmente en sujetos de un nivel de desarrollo similar. Se definen actualmente tres subtipos de TDAH, cada uno con diferente sintomatología: el tipo caracterizado por déficit de atención, el tipo predominantemente hiperactivo-impulsivo y el tipo combinado. Un criterio adicional en el DSM-IV-TR es que, para hacer el diagnóstico, estos síntomas deben estar presentes en dos o más situaciones, en la casa, el colegio y/o la sociedad. En presencia de comorbilidad, y por la diferenciación de tres subtipos de TDAH, la prevalencia es menor, entre el 5 y el 9% (23).
Fisiopatología:
Las manifestaciones en el TDAH son secundarias a trastornos en la red Fronto-estriado-cerebelosa (24) Un estudio de mapeo longitudinal del grosor de la corteza cerebral en niños con TDAH, mostró adelgazamiento de la corteza prefrontal bilateral de predominio izquierdo (25) La genética también esta comprometida en la fisiopatología del trastorno (26):
Gen receptor de Dopamina D4, D5 gen transportador de Dopamina DAT1 gen transportador de Serotonina SLC6A3 y SLC6A4 gen receptor de Serotonina 5HT1B (HTR1B) gen receptor alfa-2A adrenergico (ADRA2A) Diagnóstico:
Los criterios DSM-IV-TR exigen el cumplimiento de 6 a 9 variables en déficit de atención y en hiperactividad-impulsividad. Estas son:
Déficit de atención
• A menudo no presta atención suficiente a los detalles o incurre en errores por descuido en las tareas escolares, en el trabajo o en otras actividades. • A menudo tiene dificultades para mantener la atención en tareas o en actividades lúdicas. • A menudo parece no escuchar cuando se le habla directamente. • A menudo no sigue instrucciones y no finaliza tareas escolares, encargos, u obligaciones en el centre de trabajo (no se debe a comportamiento negativista o a incapacidad para comprender instrucciones). • A menudo tiene dificultades para organizar tareas y actividades. • A menudo evita, le disgusta dedicarse a tareas que requieren un esfuerzo mental sostenido (como trabajos escolares o domésticos). • A menudo extravía objetos necesarios para tareas o actividades (p. ej, juguetes, ejercicios escolares, lápices, libros o herramientas). • A menudo se distrae fácilmente por estímulos irrelevantes. • A menudo es descuidado en las actividades diarias.
Hiperactividad-Impulsividad • A menudo mueve en exceso manos o pies, o se remueve en su asiento. • A menudo abandona su asiento en la clase o en otras situaciones en que se espera que permanezca sentado. • A menudo corre o salta excesivamente en situaciones en que es inapropiado hacerlo (en adolescentes o adultos puede limitarse a sentimientos subjetivos de inquietud). • A menudo tiene dificultades para jugar o dedicarse tranquilamente a actividades de ocio. • A menudo “está en marcha” o suele actuar como si tuviera un motor. • A menudo habla en exceso. • A menudo precipita respuestas antes de haber sido completadas las preguntas. • A menudo tiene dificultades para guardar turno. • A menudo interrumpe o se inmiscuye en las actividades de otros (p. ej. , en conversaciones o juegos). debe haber tenido un inicio precoz (anterior a los 7 años) • Debe afectar como mínimo dos ámbitos de relación del paciente (habitualmente son la familia y la escuela) y llevar un tiempo mínimo de afectación de seis meses.
Comorbilidad
El TDAH es, junto con la dislexia, la causa más importante de fracaso escolar; tiene una alta comorbilidad con el síndrome de Tourette (11%) y trastornos de la conducta (14-40%), trastornos de ansiedad (38%), otros trastornos afectivos y retraso mental; pero no está bien establecida la relación entre el TDAH y los trastornos del sueño (TS) (27, 28). El 25-50% de niños con TDAH tienen algún problema de sueño: dificultad para dormirse, sonambulismo y dificultades para despertarse, pero no hay diferencias en el tiempo total de sueño.
El 25% de lactantes y preescolares con TS crónicos posteriormente reciben el diagnóstico de TDAH. (27, 29). Pero también existen evidencias de que las conductas diurnas anormales como la desatención, la hiperactividad y la impulsividad pueden imitar el TDAH y esto es lo más importante en el pronóstico de los niños con TS. La dificultad crónica para conciliar el sueño que se manifiesta tanto en niños como adultos diagnosticados con TDAH, también puede deberse a alteraciones crónicas de los mecanismos fisiológicos que regulan el sueño y la vigilia.
PMLS y RLS
En el RLS, que se caracteriza por el deseo de mover las extremidades y por inquietud motora, los síntomas empeoran o se presentan exclusivamente en reposo, mejoran con la actividad y se hacen más marcados al anochecer o durante la noche. Los síntomas son más graves en la fase descendente del ciclo circadiano de temperatura, y mejoran cuando se eleva la temperatura durante la mañana. Existen estudios que no han encontrado diferencias entre los TS comparando los pacientes no tratados con TDAH y los controles.
El RLS se puede diagnosticar erróneamente como TDAH; el 34% de un grupo de niños con diagnóstico de TDAH presentaba suficientes síntomas del PMLS (30).
Aunque la prevalencia del RLS en niños no está bien definida, más de una tercera parte de 138 adultos con esta condición declaró que sus síntomas habían comenzado antes de los 10 años de edad. Estudios preliminares del RLS en niños encontraron que muchos pacientes tenían déficit de atención e hiperactividad. Un trabajo encontró que 117 niños (91%) entre 129 niños tratados en un laboratorio de sueño confirmaron tener movimientos periódicos durante el sueño (más de cinco movimientos por hora) y también se encontraron criterios para diagnosticar TDAH. Datos adicionales sugieren que los niños con TDAH pueden ser más propensos a padecer RLS que otros niños. Altos índices de hiperactividad estaban asociados con el PMLS. Estos pacientes mejoraron con levodopa o agonistas dopaminérgicos. Los autores de este trabajo subrayaron que estas medicaciones pudieran mejorar la conducta por efecto directo sobre el cerebro en los mecanismos que controlan la conducta más que sobre los efectos del RLS (31) Reportes de padres de niños con TDAH describen trastornos en sus extremidades durante el sueño, declaran que desde el período de lactancia a estos bebés les cuesta conciliar el sueño (32).
Varios desórdenes de sueño han sido relatados como asociado con TDAH. Un estudio de adultos portadores del síndrome de piernas inquietas n=62, insomnio n=32 y controles adultos n=77, en el 26% de los casos con síndrome de piernas inquietas, los síntomas de TDAH eran más comunes que en los pacientes portadores de insomnio (6%) o que en los controles (5%) (P <0. 01) (33).
SAOS
El SAOS se caracteriza por intermitencia del sueño e interrupción de la ventilación seguidos de episodios de obstrucción total o parcial de las vías respiratorias superiores durante el sueño.
En 1976 se publicaron las primeras series de niños con SAOS, dificultades de aprendizaje, déficit de atención e hiperactividad como signos importantes durante el día. Series subsecuentes en los años 80 subrayaron la frecuencia de estas conductas y que algunos niños diagnosticados con TDAH, antes de acudir a un laboratorio de sueño, encontraron mejoría en los síntomas de TDAH o éstos desaparecían después del tratamiento del TS de origen respiratorio.
El SAOS asociado con hipoxia, pudieran afectar a un cerebro en desarrollo. Un modelo de apnea de sueño producido en ratas jóvenes sometidas a hipoxia intermitente evidenció apoptosis del hipocampo y la corteza cerebral. Sin embargo, los cambios histológicos fueron transitorios, asociados al aprendizaje visuoespacial, y remitieron dos semanas después de la lesión (34).
En un estudio de 12 niños con trastornos respiratorios del sueño a los que se les practicó adenoidectomía y se compararon con 10 sujetos controles en el postoperatorio, y se hicieron encuestas a los padres, la agresión, el déficit de atención, la hiperactividad y el funcionamiento manifestados en los tests, mostraron mejoría en el grupo con trastornos respiratorios, pero no hubo cambios en el grupo control. Los niños con ronquido primario mostraron mejoría en algunas áreas. Habitualmente, el ronquido explica el 16% de la variabilidad en el DSM-IV según la escala de déficit de atención e hiperactividad. Estos hallazgos sugieren que los trastornos respiratorios del sueño contribuyen a la conducta hiperactiva y los niños pequeños pueden ser más vulnerables. En una revisión basada en la evidencia del subcomité de la Academia Americana de Pediatría, 12 publicaciones enunciaban una asociación elevada entre trastornos del sueño respiratorios y trastornos cognitivos y conductuales.
Cuando los autores reunieron los resultados de seis estudios, concluyeron que la combinación de los trastornos de conducta y el ronquido en niños fue de 2, 93. Los estudios publicados que indican que la hiperactividad es particularmente frecuente en niños con trastornos respiratorios durante el sueño no se han evaluado prospectivamente utilizando los criterios del DSM-IV. En otros dos estudios, los trastornos respiratorios durante el sueño, se evidenció en el 50 % (17/34) al 76 % (67/88) de niños TDAH, y los movimientos periódicos de las piernas durante el sueño, fueron relatados en el 10 % (9/88) al 15 % (5/34). (35, 29)
Registros Polisomnográficos de niños con TDAH comparando controles normales demuestran un aumento del porcentaje de fase III del sueño, paroxismos epileptiformes también han sido relatados en el 16. 7 % de niños de estos niños. (36)
Objetivo
Describir los trastornos del sueño encontrados a través del estudio polisomnográfico nocturno en una muestra de 10 niños con diagnostico de trastorno por déficit de atención con hiperactividad del tipo Hiperactivo-Impulsivo.
Materiales y Métodos
Se estudiaron 10 niños, 1 del sexo femenino y 9 masculinos con media de edad 9, 30 y DS: 4, 498148, Los cuales fueron diagnosticados según los criterios del DSM IV como TDAH del tipo Hiperactivo-Impulsivo por un especialista en psiquiatría infantil. Se les realizó además una exploración neurológica en una consulta previa donde se determinó proceder a la polisomnografía, la cual se realizó en una habitación climatizada, en penumbra, libre de ruido. Los pacientes fueron monitorizados durante las horas que permanecieron en la habitación acostados ya fuera en vigilia o dormidos.
La polisomnografía consistió en la monitorización y registro continuo durante al menos 6 horas de sueño del paciente en horario nocturno de las siguientes variables:
- electroencefalograma (EEG) - Electrooculograma (EOG) - Electromiograma submentoniano y en ambos miembros inferiores (EMG) - Flujo aéreo naso – bucal - Esfuerzo respiratorio Toráxico y Abdominal - Posición corporal - Sensor de ronquido - Saturación de oxigeno en sangre capilar
Se utilizó el equipo digital Medicid IV de producción nacional, el cual consta de 19 canales de electroencefalografía y 8 canales DC, este fue acoplado a una computadora Pentium IV. Se analizaron las siguientes variables:
Tiempo Total de Registro (TTR)
Tiempo Total de sueño (TTS)
Latencia de Sueño
# De Ciclos REM-NREM
Latencia de REM
% en cada fase (valores normales en vigilia 5%, REM 20%, FI 5%, FII 50%, FIII 10%, FIV 10%)
# De Entradas en Vigilia
Índice de Arousal
Índice de Movimientos de Piernas
Índice de Apnea/Hipopnea
Eficiencia del sueño (Con respecto al TTR y al TTS)
Resultados
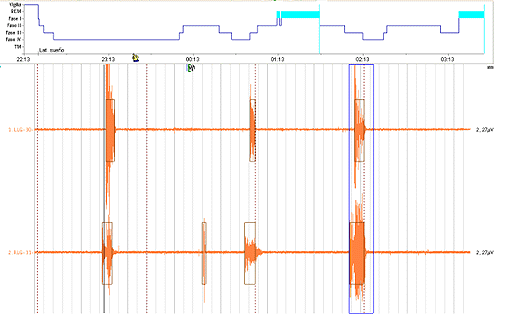
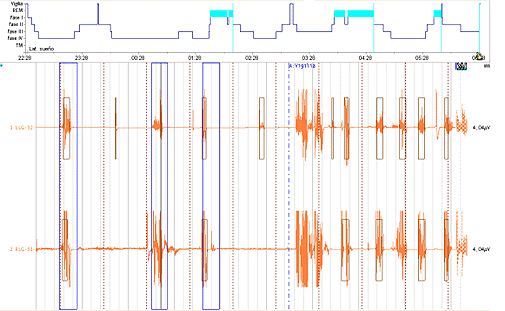
Todos los estudios fueron anormales, 7 de los niños presentó PMLS, (figuras 1 y 2 de los anexos, muestan secuencias de movimientos periódicos de piernas obtenidas de las polisomnografías). La arquitectura del sueño en 8, mostró incremento en el porciento de la FIII y una disminución de la FII del sueño de ondas lentas. La latencia de REM estuvo aumentada en 7 de ellos, sin embargo el porcentaje del REM disminuido en 5 del total registrado. El índice de arousal estuvo aumentado en 7 de estos niños. 4 de los registros evidenciaron actividad paroxística y en 4 las parasomnias referidas por los padres fueron confirmadas.
Conclusion
Aunque la casuística evaluada es aún poca llama la atención la existencia de una alta frecuencia de PMLS en los 10 niños portadores de TDAH del tipo Hiperactivo-Impulsivo.
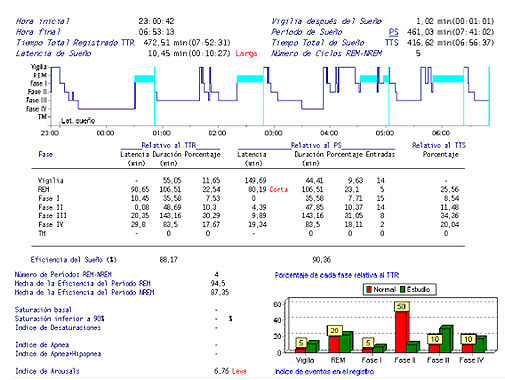
No se evidenció la presencia de SAOS en ninguno de ellos. Se comprobó la existencia de severas alteraciones en la arquitectura del sueño. (Figura 3 de los anexos). El incremento de la fase III puede estar relacionado con alteraciones en la transmisión noradrenalina y dopamina que se describen en el trastorno por déficit de atención con hiperactividad.
La actividad epiléptica evidenciada en estos niños no tiene una traducción clínica de propiamente establecidas, pero pueden estar comprometidas en los trastornos de conducta presentados por estos niños.
Bibliografía
1. McGinty D, Szymusiak R. The sleep-wake switch: a neuronal alarm clock. Nature Med 2000; 6: 510-1.
2. Daan S, Beersma DG, Borbely AA. Timing of human sleep: recovery process gated by a circadian pacemaker. Am J Physiol 1984; 246(2 Pt 2):R161-83.
3. Maquet P, Péters JM, Aerts J, Delfiore G, Degueldre C, Luxen A, et al. Functional neuroanatomy of human rapid-eye-movement sleep and dreaming. Nature 1996; 383: 163-6.
4. Braun AR, Balkin TJ, Wesensten NJ, Gwadry F, Carson RE, Varga M, et al. Regional cerebral blood flow throughout the sleep-wake cycle. Brain 1997; 120: 1173-97.
5. Hobson JA, Pace-Schott EF, Stickgold R, Kahn D. To dream or not to dream? Relevant data from new neuroimaging and electrophysiological studies. Curr Opin Neurobiol 1998; 8: 239-44.
6. Benoît O. Régulation circadienne desétats de veille et de sommeil. In: Le sommeil humain. Bases expérimentales physiologiques et physiopathologiques. Paris: Masson; 1995. p. 105-24.
7. Borbely A, Acheman P. Concepts and models of sleep regulation: an overview. J Sleep Res 1992; 1: 63-79.
8. Daan S, Beersma D, Borbely A. Timing of human sleep: recovery process gated by a circadian pacemaker. Am J Physiol 1984; 246:R161-78.
9. Folkard S, Akerestedt T. A three process model of regulation of alertness sleepiness. In: Broughton R, Olgivie R, editors. Sleep arousal and performance. Boston: Birkhauser; 1992. p. 11-26.
10. Foret J. Variations spontanées et expérimentales. In: Benoît O, editor. Le sommeil humain. Bases expérimentales, physiologiques et physiopathologiques. 2nd ed. Paris: Masson; 1995. p. 75-88.
11. Besset A. Régulation du sommeil. Rev Prat 1996; 46:2411-5.
12. Gaillard J. Le sommeil normal et les elements de physiologie. In: Le sommeil: ses mécanismes et ses troubles. Paris: Doin; 1990. p. 31-92.
13. Saper CB, Chou TC, Scammell TE. The sleep switch: hypothalamic control of sleep and wakefulness. Trends Neurosci 2001; 24: 726-31.
14. Gallopin T, Fort P, Eggermann E, Cauli B, Luppi PH, Rossier J, et al. Identification of sleeppromoting neurons in vitro. Nature 2000; 404: 992-5.
15. Reinoso Suárez F, de Andrés I, Rodrigo Angulo M, Garzón M. Brain structures and mechanisms involved in the generation of REM sleep. Sleep Med Rev 2001; 5: 63-77.
16. Peyron C, Tighe DK, Van den Pol AN, de Lecea L, Heller HC, Sutcliffe JG, et al. Neurons containing hypocretin (orexin) project to multiple neuronal systems. J Neurosciense 1998; 18: 9996- 10015.
17. Nishino S, Ripley B, Overeem S, Nevsimalova S, Lammers GJ, Vankova J, et al. Low cerebrospinal fluid hypocretin (orexin) and altered energy homeostasis in human narcolepsy. Ann Neurol 2001; 50: 381-8.
18. The International Classification of Sleep Disorders. Diagnostic and Coding Manual. Diagnostic Classification Steering Committee. Thorpy MJ, chairman. Rochester: American Sleep Disorders Association, 1990.
19. American Sleep Disorders Association. International Classification of Sleep Disorders, revised: diagnostic and coding manual, Rochester: American Sleep Disorders Association 1997.
20. Association of Sleep Disorders Centers, Diagnostic Classification of Sleep and arousal Disorders, prepared by the Sleep Disorders Classification Committee; Roffwarg HP, chairman. Sleep 1979; 2:1-137.
21. Culebras A. patología general de los trastornos del sueño. En: Culebras A, editor. La medicina del sueño. Barcelona: Ancora, 1994; p. 39-56.
22. Pin-Arboledas G. Alteraciones del sueño en el niño: enfoque desde la asistencia primaria. Rev Neurol 2000; 30: 178-86.
23. Miranda-Casas A, Jarque S, Soriano M. trastorno de hiperactividad con déficit de atención: polémicas actuales acerca de su definición, epidemiología, bases etiológicas y aproximaciones a la intervención. In Mulas F, ed. trastorno por déficit de atención e hiperactividad. Barcelona: Viguera; 2004. p. 3-18.
24. Smith AB, et al. Am J Psychiatry 2006; 163: 1044-1051.
25. Shaw P, et al. Arch gen Psychiatry 2006; 63:540-549.
26. Wang B, et al. Am J Med Genetics 2006; 141:130-134
27. Howard BJ, Wong J. Sleep disorders. Pediatr Rev 2001; 22: 327-43.
28. Picchietti DL, Walters AS. Restless legs syndrome and periodic limb movement disorder in children and adolescents: comorbidity with attention-deficit hyperactivity disorder. Child Adolesc Psychiatr Clin N Am 1996; 5: 729-40.
29. Huang YS, Chen NH, Li HY, Wu YY, Chao CC, Guilleminault C. Sleep disorders in Taiwanese children with attention deficit/hyperactivity disorder. J Sleep Res 2004; 13: 269-77.
30. Chervin RD, Archbold KH, Dillon JE. Associations between symptoms of inattention, hyperactivity, restless legs, and periodic leg movements. Sleep 2002; 25: 213-218.
31. Kirov R, Kinkelbur J, Heipke S, Kostanecka-Endress T, Westhoff M, Cohrs S, et al. Is there a specific polysomnographic sleep pattern in children with attention deficit/hyperactivity disorder? J Sleep Res 2004; 13: 87-93.
32. Brown TE, Modestino EJ. Trastornos por déficit de atención con trastornos del sueño. In Brown TE, eds. Trastornos por déficit de atención y comorbilidades en niños, adolescentes y adultos. Barcelona: Masson; 2003. p. 341-62.
33. Wagner ML, Walters AS, Fisher BC. Symptoms of attention-deficit/hyperactivity disorder in adults with restless legs syndrome. Sleep. 2004; 27:1499-1504.
34. Gozal D, Daniel JM, Dohanich GP. Behavioural and anatomical correlates of chronic episodic hypoxia during sleep in the rat. J Neurosci 2001; 21: 2442-50.
35. Golan N, Shahar E, Ravid S, Pillar G. Sleep disorders and daytime sleepiness in children with attention-deficit/hyperactive disorder. Sleep. 2004; 27:261-266.
36. Bernal Lafuente M, Valdizan JR, Garcia Campayo J. Nocturnal polysomnographic study in children with attention deficit hyperactivity disorder [in Spanish]. Rev Neurol. 2004; 38(suppl 1):S103-S110.
Figura 1: Secuencias de movimientos periódicos durante el sueño. Fuente: Polisomnografía
Anexo
Figura 2: Secuencias de movimientos periódicos durante el sueño, lo cual distorsiona la arquitectura del mismo provocando una entrada abrupta a vigilia. Fuente: Polisomnografía
Figura 3: Severas alteraciones de la arquitectura del sueño. Fuente: Polisomnografía
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.
El TDAH desde el paradigma de la Inclusión. Necesidad de un abordaje pedagógico integral y eficaz
Ernesto José Cañabate Reyes et. al
Fecha Publicación: 18/05/2025
Revisión del tratamiento del trastorno por déficit de atención con hiperactividad
Maria Antonia González Fe
Fecha Publicación: 20/05/2024
Análisis de la validez concurrente del serious game Attention Robots® y NESPLORA en población infantil y adolescente
Nicolás Ruiz Robledillo et. al
Fecha Publicación: 20/05/2024
Analisis de la correlación entre el serious game Atenttion Slackline® y NESPLORA en niños y adolescentes
Rosario Ferrer Cascales et. al
Fecha Publicación: 20/05/2024
La importancia del ambiente en el Síndrome de Asperger
Maria Basteguieta Gardeazabal
Fecha Publicación: 18/05/2023
Relevancia del Omega 6 (GLA) agregado a los suplementos de Omega 3 para el TDAH: una revisión narrativa
Jelle D'Helft
Fecha Publicación: 17/10/2022