El sistema noradrenérgico central juega un importante papel fisiológico en la génesis de la depresión y en el mecanismo de acción de los antidepresivos, a pesar de la disparidad de los resultados obtenidos en los numerosos estudios experimentales y clínicos realizados. Si la disfunción noradrenégica es la responsable o la consecuencia del trastorno afectivo continúa siendo motivo de discusión.
Pero, lo que es realmente innegable es que la inhibición selectiva de la recaptación de noradrenalina y el consiguiente incremento del funcionalismo noradrenérgico constituye un proceder terapéutico realmente eficaz en la enfermedad depresiva. El reciente desarrollo de nuevos fármacos con propiedades bloqueantes selectivas de la recaptación de noradrenalina, como la reboxetina, permitirá clarificar el papel etiopatogénico de la noradrenalina en la depresión.
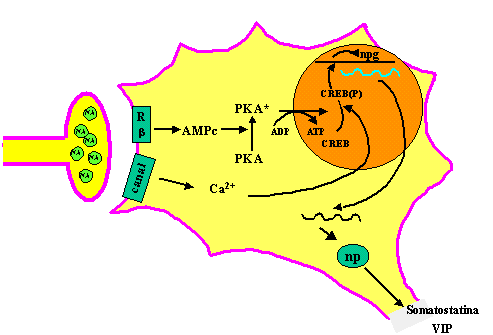
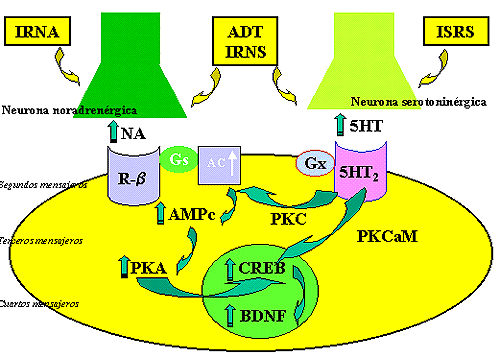
Posiblemente, la activación noradrenérgica constituye el primer eslabón de una cascada de reacciones bioquímicas propici! adas también por otros neurotransmisores en las que a través de segundos mensajeros, regulados por proteínas G, se activen protein-kinasas y factores de transcripción que conllevan a la síntesis de factores neurotróficos o de proteínas estructurales imprescindibles para mantener el equilibrio afectivo.
Hipótesis noradrenérgica de la depresión y su implicación en el desarrollo de fármacos antidepresivos.
(Depression noradrenergic hypothesis and its implication in the development of antidepressant drugs. )
E. Cuenca; C. Alamo; F. López-Muñoz; B. Martín; P. García-García.
Departamento de Farmacología, Universidad de Alcalá, Madrid
PALABRAS CLAVE: depresión, Etiología, noradrenalina, antidepresivos.
(KEYWORDS: Depression, Etiology, Noradrenaline, Antidepressant. )
página 1
[otros artículos] [7/2/2002]
Resumen
El sistema noradrenérgico central juega un importante papel fisiológico en la génesis de la depresión y en el mecanismo de acción de los antidepresivos, a pesar de la disparidad de los resultados obtenidos en los numerosos estudios experimentales y clínicos realizados. Si la disfunción noradrenégica es la responsable o la consecuencia del trastorno afectivo continúa siendo motivo de discusión. Pero, lo que es realmente innegable es que la inhibición selectiva de la recaptación de noradrenalina y el consiguiente incremento del funcionalismo noradrenérgico constituye un proceder terapéutico realmente eficaz en la enfermedad depresiva. El reciente desarrollo de nuevos fármacos con propiedades bloqueantes selectivas de la recaptación de noradrenalina, como la reboxetina, permitirá clarificar el papel etiopatogénico de la noradrenalina en la depresión. Posiblemente, la activación noradrenérgica constituye el primer eslabón de una cascada de reacciones bioquímicas propici! adas también por otros neurotransmisores en las que a través de segundos mensajeros, regulados por proteínas G, se activen protein-kinasas y factores de transcripción que conllevan a la síntesis de factores neurotróficos o de proteínas estructurales imprescindibles para mantener el equilibrio afectivo.
Abstract
The central noradrenergic system plays an important physiological role in the depression etiology and in the action mechamism of the antidepressant drugs, despite the disparity of the results obtained in the numerous experimental and clinical studies carried out. Whether the noradrenergic disfunction is the cause or the consequence of the affective disorder continues being a subject of discussion. Notwithstanding, the fact really undeniable is that the selective inhibition of the noradrenaline reuptake and, consequently, the increase of the noradrenergic function, constitutes an effective therapeutical procedure in depressive disease.
The recent development of new drugs with selective noradrenaline reuptake inhibition properties, such as reboxetine, will allow to clarify the etiopathogenic role of the noradrenaline in the depression. Perhaps, the noradrenergic activation constitutes the first link of a series of biochemical reactions caused by other neurotransmisors, in which, and through second messengers ruled by proteins G, protein-kinases and transcription factors involving the synthesis of neurotrofic factors or of the necessary structural proteins to maintain the affective balance are activated.
Introducción
El estudio y la comprensión del funcionalismo de un sistema de neurotransmisión en el sistema nervioso central (SNC) es un problema sumamente arduo y complejo. De hecho, en cualquier órgano somático, el conocimiento de la acción celular de un fármaco proporciona una idea bastante clara de cómo va a afectar este agente al órgano en su conjunto. En el SNC esta hipótesis no se cumple. ello es debido, entre otras circunstancias, a que una característica fundamental del SNC es la enorme capacidad de comunicación interneuronal, hecho que, a la vez que pone en contacto diversos sistemas de neurotransmisión, dificulta el estudio de un sistema aislado.
Por otra parte, intentar estudiar un sistema de neurotransmisión de forma aislada puede ser interesante, e incluso necesario, desde el punto de vista docente e investigador, pero, cuando se trata de problemas de la mente, de su fisiopatología y de su terapéutica, no deja de ser una visión tremendamente reduccionista. El abordaje de este análisis debe contemplar las múltiples interacciones entre los sistemas de neurotransmisión, aminérgicos y no aminérgicos, tanto a nivel sináptico como a nivel de los mecanismos intracelulares responsables de las acciones neuronales.
Siguiendo estos postulados, en la presente ponencia se revisarán los conocimientos más recientes relativos al sistema de neurotransmisión noradrenérgico, a su implicación en la fisiopatología de los trastornos depresivos y a su papel en el desarrollo de fármacos antidepresivos de acción selectiva sobre este sistema.
Hipótesis noradrenérgica de la depresión
Antecedentes históricos
Durante la década de los 60 florecieron las teorías monoaminérgicas de la depresión, que postulaban una deficiencia funcional de la neurotransmisión noradrenérgica o serotoninérgica en determinadas áreas cerebrales como causa primordial de estas patologías (Coppen, 1967).
La “hipótesis catecolaminérgica” fue la primera que se postuló, en base a las observaciones efectuadas sobre los efectos de los fármacos antidepresivos recién descubiertos (López-Muñoz y cols. , 1998); la acción inhibitoria de la monoaminooxidasa (mao) por parte de la iproniazida (Zeller y cols. , 1952), el bloqueo de la recaptación sináptica de noradrenalina por parte de la imipramina (Glowinski y Axelrod, 1964) y el hecho de que la reserpina, alcaloide que produce una depleción de noradrenalina en las terminaciones nerviosas, provocaba síntomas depresivos en un porcentaje elevado de pacientes al ser utilizada como antihipertensivo (Goodwin y Bunney, 1971). A favor de esta teoría, también se posicionaron Schildkraut y cols. (1967), al observar como las sales de litio, efectivas en el tratamiento de las fases maníacas de los trastornos bipolares, disminuían la tasa cerebral de noradrenalina, efecto contrario al observado con los antidepresivos tricíclicos (ADT). De esta forma, los estados maníacos se deberían, en oposición a los cuadros depresivos, a un exceso catecolaminérgico en el SNC.
Esta hipótesis sobre el mecanismo biológico de la depresión, presentada en un clásico trabajo en 1965, concluía que esta entidad patológica se debía a un descenso de los niveles de noradrenalina en la hendidura intersináptica. Este es pues el punto de partida de la “hipótesis catecolaminérgica” de la depresión, postulada por Schildkraut en 1965 y que textualmente transcribimos: “algunas depresiones, si no todas, están asociadas a un déficit absoluto o relativo de catecolaminas, particularmente noradrenalina, en receptores adrenérgicos importantes en el cerebro. Contrariamente, la elación puede estar asociada a un exceso de dichas aminas”.
En esta misma época comenzó a gestarse la “hipótesis serotoninérgica”. Desde 1952, gracias a los trabajos de Betty Twarog, se sabía que la serotonina era un neurotransmisor cerebral (Twarog, 1988). Bernard Brodie y sus colegas del Laboratory of Chemical Pharmacology del National Heart Institute, descubrieron, en 1955, que la administración de reserpina a los animales de experimentación ocasionaba una gran depleción tisular de serotonina, incluyendo el cerebro (Pletscher y cols. , 1955). En 1967, Coppen y colaboradores demostraron que la administración de triptófano, un precursor de la serotonina, a animales deprimidos potenciaba los efectos terapéuticos de los inhibidores de la MAO (IMAOs), y en 1968 Carlsson y colaboradores describen, por primera vez, como los ADT bloquean la captación de serotonina a nivel cerebral. De esta forma, en 1970, Lapin y Oxenkrug postulan la teoría serotoninérgica de la depresión, en oposición a la hipótesis catecolaminérgica, basada en un déficit de serotonina a nivel intersináptico en determinadas regiones cerebrales.
El papel de la serotonina en la génesis de la depresión fue tan estudiado durante las décadas de los 70 y los 80, que la noradrenalina se convirtió en el “neurotransmisor olvidado” (Van Moffaert y Dierick, 1999).
Algunos autores intentaron, posteriormente, conciliar ambas hipótesis, de forma que distintos componentes del “síndrome depresivo” serían debidos a la disminución de una determinada amina biológica. De esta forma, el enlentecimiento motor típico de la depresión sería achacable al déficit noradrenérgico y la afectación del humor a la disminución de la serotonina. Además, se hablaba de distintos tipos de depresiones en las que dominaría más intensamente alguno de los dos déficits bioquímicos.
Teorías mucho más recientes (Siever y Davis, 1985) proponen un modelo de “disregulación”, en el que no estaría implicada una sola vía de neurotransmisores, sino una alteración de varias vías, incluyendo la noradrenérgica, serotoninérgica y dopaminérgica. Siguiendo estos postulados, Delgado y Moreno (2000) proponen un modelo etiológico en el que la depresión resultaría de una disfunción de distintas áreas cerebrales, entre las que destacarían la corteza frontal, el hipocampo, la amígdala y los ganglios basales, que, a su vez, estarían moduladas por diferentes sistemas de neurotransmisión monoaminérgicos.
Según esta teoría, numerosos factores, entre los que destaca el estrés, podrían incidir en el correcto funcionamiento de estas áreas, bien de forma selectiva o generalizada, lo que concuerda con los clásicos postulados de una etiología heterogénea de los trastornos depresivos.
Con el fin de demostrar el papel etiopatogénico de la noradrenalina en esta sugestiva hipótesis, se han llevado a cabo una serie de estudios en pacientes depresivos y en animales de laboratorio (Alamo y cols. , 2000).
Su exposición y análisis crítico se realizan en este trabajo, aunque como veremos, los resultados han sido en muchos casos contradictorios, debido, posiblemente, a la selección de las muestras, a errores diagnósticos, al empleo de pautas posológicas inadecuadas, a diferentes metodologías en las determinaciones, etc.
Parámetros noradrenérgicos en el SNC
Estudios post mortem
Algunos autores han observado una serie de modificaciones en parámetros noradrenérgicos en estudios post mortem (Tabla I), aunque la fiabilidad de los resultados obtenidos en este tipo de estudios no es muy grande (particularmente, en el caso de las monoaminas), debido a las limitaciones que conllevan (causa de muerte, tiempo transcurrido hasta la obtención de la muestra, medicación, etc. ).
TABLA I: Parámetros noradrenérgicos en diferentes áreas cerebrales de pacientes depresivos, según estudios post mortem
MHPG (3-metoxi-4-hidroxifenilglicol)
(sin modificación); (aumento); (disminución).
Tomada de Alamo y cols. (2000).
Así, se ha descrito un incremento de la densidad de los receptores -adrenérgicos en la corteza frontal de víctimas de suicidio en comparación con los controles (Zanko y Beigon, 1983; Mann y cols. , 1986; Arango y cols. , 1990). Sin embargo, el estudio llevado a cabo por De Paermentier y colaboradores (1990) en pacientes depresivos no sometidos a tratamiento antidepresivo y que se habían suicidado, no confirmó estos hallazgos.
En relación con los receptores 2-adrenérgicos, Meana y cols. (1992) han señalado que tanto la densidad como la afinidad de estos receptores estaba incrementada en el cortex prefrontal y en el hipotálamo de individuos depresivos fallecidos por suicidio. La fijación específica de agonistas selectivos (3H-clonidina y 3H-UK14, 34), así como la potencia de la noradrenalina para desplazar al antagonista 3H-idazoxan de sus lugares de fijación en el cortex frontal de pacientes depresivos se incrementaron significativamente. Estudios recientes, sin embargo, hablan en favor de la existencia de diferentes subtipos de receptores 2-adrenérgicos (Bricca y cols. , 1989; De Vos y cols. , 1991). Por otra parte, estos mismos autores observaron un incremento en la densidad de los lugares de fijación de 3H-idazoxan en el cortex frontal de depresivos, que eran distintos de los receptores 2-adrenérgicos, lo que refleja una posible falta de selectividad receptorial de los radioligandos empleados. En cuanto a los receptores 1-adrenérgicos, también se han observado cambios discretos en su densidad (Cheetham y cols. , 1991).
Con respecto al transportador de noradrenalina, se ha observado una disminución marcada de la unión de nisoxetina radiomarcada, un ligando específico de este transportador, en el locus coeruleus (LC) de cerebros de pacientes suicidas con historial depresivo en comparación con muestras post mortem controles (Klimek y cols. , 1997). También se ha descrito una disminución de la densidad de neuronas en LC de individuos suicidas depresivos, en comparación con la población normal (Arango y cols. , 1996).
En relación con los niveles de noradrenalina en el SNC, la mayoría de los estudios realizados han confirmado que en el hipotálamo, la corteza cerebral y el núcleo caudado de víctimas de suicidio éstos se mantienen dentro del rango normal (Pare y cols. , 1969; Riederer y cols. , 1980), aunque se han detectado niveles más bajos en el núcleo putamen en comparación con los controles (Beskow y cols. , 1976). Por su parte, en la determinación de los niveles de 3-metoxi-4-hidroxi-fenilglicol (MHPG), expresión del recambio (“turnover”) de noradrenalina, también se han obtenido resultados dispares. En algunos pacientes con depresión endógena que se habían suicidado, los niveles de MHPG en algunas regiones cerebrales eran menores a los obtenidos en individuos no depresivos que habían fallecido por causas naturales (Riederer y cols. , 1980). Sin embargo, en otro estudio similar, no se observaron diferencias significativas de los niveles de MHPG entre pacientes depresivos y controles (Crow y cols. , 1984).
Otro marcador del funcionalismo noradrenérgico, como es la determinación de la actividad tirosina-hidroxilasa (TH) en el LC de víctimas de suicidio, ha dado también resultados contradictorios. Así, mientras Beigon y Fieldeust (1992) encontraron una actividad reducida, Ordway y cols. (1994), contrariamente, observaron un aumento en comparación con los controles. El incremento de los niveles de TH observado en este estudio no era consecuente al aumento del número de neuronas, lo que apoya la interpretación que las diferencias observadas se deben al incremento de la concentración de TH de las neuronas del LC.
En estudios preclínicos recientes se han confirmado los resultados previamente descritos, que demostraban que la administración crónica de antidepresivos a la rata disminuía la descarga del LC y las concentraciones de TH o de RNAm de la TH (Valentino y cols. , 1990; Melia y cols. , 1992).
Estos resultados sugieren que el efecto clínico de los antidepresivos puede ser consecuente con una regulación a la baja de la biosíntesis de noradrenalina. Así pues, tanto los estudios clínicos como experimentales hablan a favor de que en la depresión existe una alteración de la actividad TH y que el tratamiento crónico con antidepresivos revierte esta disfunción, habiéndose sugerido que podrían ejercer este efecto a nivel de la expresión génica de la TH (Leonard, 1997a).
En conclusión, debido a la disparidad de los resultados obtenidos (Tabla I) y a las limitaciones que conllevan los estudios post mortem resulta aventurado proponer alguna conclusión válida que englobe de forma coherente los hallazgos descritos. No obstante, y a modo de hipótesis, no resulta ilógico pensar que el incremento de los autorreceptores 2-adrenérgicos provoca una disminución de la neurotransmisión noradrenérgica, que se traduce en una disminución de los niveles de noradrenalina y MHPG y, en consecuencia, a través de un mecanismo homeostático, se incrementa la densidad de los receptores -adrenérgicos y la actividad de la TH.
Evaluación indirecta de los receptores adrenérgicos centrales mediante pruebas neuroendocrinas
La posible disfunción receptorial de un sistema de neurotransmisión a nivel central puede indirectamente evaluarse a nivel clínico, si se dispone de un fármaco cuya respuesta biológica sea consecuente con la estimulación o inhibición selectiva de los receptores específicos del sistema de neurotransmisión investigado. La cuantificación de la respuesta en los pacientes y en los voluntarios sanos y su ulterior análisis comparativo permite evaluar si existen diferencias estadísticamente significativas en el funcionalismo del sistema a nivel receptorial y su grado de afectación en la condición patológica estudiada. Esta forma de proceder, ampliamente utilizada en las investigaciones etiopatogénicas de diversos trastornos psicopatológicos, ha sido también empleada para evaluar la posible disfunción noradrenérgica en la enfermedad depresiva (Cuenca y cols. , 1996).
Varios agentes farmacológicos han sido empleados en este tipo de estudios, pero, el más utilizado ha sido la clonidina, inicialmente considerado como un agonista parcial selectivo de los receptores 2-adrenérgicos. Debido a la estimulación de estos receptores a nivel del tronco cerebral, la clonidina reduce la actividad aferente adrenérgica, es decir, el tono simpático central. Su administración a voluntarios sanos produce sedación, hipotensión, bradicardia, disminución de los niveles plasmáticos de MHPG y aumento de los niveles plasmáticos de hormona del crecimiento (gh). Este último efecto es, al parecer, consecuente con la inhibición de la liberación de somatostatina y/o de somatocrinina (GHRH), acciones mediadas por la activación de receptores 2-adrenérgicos postsinápticos a nivel hipotalámico. Parte de este perfil farmacodinámico se modifica en los pacientes depresivos. En efecto, la sedación, los efectos tensionales y el incremento de los niveles de MHPG son prácticamente similares en los pacientes depresivos y en los controles, lo que ha llevado a la mayor parte de los autores a la conclusión de que el funcionalismo de los receptores 2-adrenérgicos presinápticos no está alterado en la depresión (Heninger y cols. , 1990). Sin embargo, en la mayoría de los estudios realizados en pacientes depresivos se ha observado una disminución de la liberación de GH tras la administración de clonidina, en comparación con los controles (Matussek y cols. , 1980; Checkley y cols. , 1981; Charney y cols. , 1982a; Siever y cols. , 1992).
Estos últimos resultados, replicados por diversos autores, han sido generalmente interpretados como una demostración evidente de la subsensibilidad o regulación a la baja de los receptores 2-adrenérgicos postsinápticos del SNC en la depresión, ya que, como antes hemos comentado, la liberación de GH inducida por la clonidina se considera mediada a través de la estimulación de estos receptores (Matussek, 1988). En general, se considera un marcador de rasgo, ya que persiste en los pacientes depresivos después de su recuperación (Mitchell y cols. , 1988). No obstante, existe una cierta controversia en relación al mecanismo responsable de esta observación, ya que la clonidina estimula los receptores 2-adrenérgicos postsinápticos y presinápticos, los cuales ejercen efectos opuestos en relación a la liberación de GH. Tampoco debe descartarse la posible mediación de los receptores imidazolínicos en las respuestas farmacológicas de la clonidina (Boyajian y Leslie, 1987; Bricca y cols. , 1989). Finalmente, es preciso resaltar que un aplanamiento similar en la respuesta de GH a la clonidina ha sido también descrito en pacientes con trastorno de pánico, ansiedad generalizada, trastorno obsesivo-compulsivo e incluso, en fases maníacas (Potter y Manji, 1994).
Por otra parte, tanto la apomorfina (antagonista dopaminérgico), como la anfetamina (bloqueante de la recaptación de noradrenalina y dopamina) y la mCPP (agonista serotoninérgico) también disminuyen la liberación de GH. Asimismo, en este proceso también intervienen las somatomedinas, las cuales están alteradas en los pacientes depresivos (Gerner y Yamada, 1982).
Independientemente de todas estas consideraciones, la administración de desipramina a pacientes depresivas endógenas premenopáusicas (Meesters y cols. , 1985) y a varones con depresión endógena (Laakmann y cols. , 1986) también disminuye la liberación de GH. Este antidepresivo noradrenérgico incrementa, en los voluntarios sanos, los niveles plasmáticos de GH, cortisol y MHPG (Charney y cols. , 1981a), a través, predominantemente, de la estimulación de receptores 2-adrenérgicos postsinápticos (Laakmann y cols. , 1977).
La yohimbina, contrariamente a la clonidina, es un antagonista de los receptores 2-adrenérgicos, por lo que también ha sido considerada su utilización para estudiar la implicación de la noradrenalina en la depresión. Su administración a voluntarios sanos incrementa la presión sanguínea, la síntesis de cortisol y los niveles plasmáticos de MHPG (Charney y cols. , 1982b; Goldberg y cols. , 1986). Sin embargo, administrada por vía intravenosa en los pacientes depresivos provoca, en comparación con los voluntarios sanos, un mayor incremento del cortisol y de la presión sanguínea, mientras que los niveles plasmáticos de MHPG no difieren en ambos grupos (Price y cols. , 1986; Heninger y cols. , 1988). Estos resultados sugieren una subsensibilidad relativa de los receptores 2-adrenérgicos postsinápticos y un aumento de la sensibilidad de los receptores 2-adrenérgicos presinápticos en la depresión, datos que contradicen los obtenidos con la clonidina (Anand y Charney, 1997). Sin embargo, no debe olvidarse que los cambios en los niveles de cortisol, como medida de la sensibilidad receptorial en la depresión, son menos fiables, ya que frecuentemente se observan alteraciones en el eje hipotálamo-hipófiso-adrenal (HHA) (Anand y Charney, 1997).
Por último, hay que mencionar que, en más de 50 estudios, sobre un total de 1000 pacientes con depresión mayor, se ha encontrado una reducción de la respuesta de la tirotropina (TSH) a la hormona liberadora de tirotropina (TRH) en un 25% de los pacientes (Loosen y Prange, 1982). Estos resultados hablan a favor de una disminución de la neurotransmisión noradrenérgica central a nivel de los receptores -adrenérgicos, ya que al parecer, la activación de estos receptores estimula la secreción de TRH. El poder discriminativo de esta prueba neuroendocrina entre pacientes melancólicos, con o sin delirio, es nulo, ya que no se han encontrado diferencias en los resultados obtenidos en ambos grupos (Levy y Stern, 1987; Contreras y cols. , 1997).
Otras pruebas indirectas del funcionalismo noradrenérgico central
El funcionalismo noradrenérgico central también puede ser evaluado mediante otras pruebas indirectas, como las modificaciones de los niveles de melatonina o de la hormona liberadora de corticotropina (CRH).
El incremento de los niveles plasmáticos de melatonina durante la noche es menor en los pacientes depresivos que en los controles (Frazer y cols. , 1986). Estos resultados hablarían a favor de una disminución del funcionalismo noradrenérgico, ya que, en general, se considera que la síntesis y la secreción nocturna de melatonina es consecuente con la estimulación noradrenérgica directa de los receptores -adrenérgicos situados en las células de la glándula pineal. El efecto resultante de esta estimulación es la transformación de serotonina en melatonina (Reiter, 1991), la cual es bloqueada por la administración de propranolol (Brownstein y Axelrod, 1974). Debido a este mecanismo, el tratamiento con desipramina (Cowen y cols. , 1985; Palazidou y cols. , 1992), clorgilina o tranilcipromina (Murphy y cols. , 1986; Golden y cols. , 1988), eleva los niveles plasmáticos de melatonina, al incrementarse la transmisión noradrenérgica.
Sin embargo, estas observaciones contradicen los resultados obtenidos en estudios preclínicos, en los que la administración crónica de antidepresivos disminuye el funcionalismo -adrenérgico (Heninger y cols. , 1990), lo que determina, por tanto, una disminución de los niveles de melatonina. No obstante, no debe olvidarse que la depleción aguda de triptófano en pacientes depresivos determina también una reducción de la secreción nocturna de melatonina, posiblemente secundaria a la disminución de los niveles plasmáticos de triptófano y, por ende, de la concentración cerebral de serotonina. Por dicho motivo, no debe descartarse la posible implicación de la serotonina en el menor incremento nocturno de la melatonina en los pacientes depresivos. Por otra parte, las alteraciones del sueño, frecuentemente observadas en la depresión, pueden también constituir un factor de confusión (Anand y Charney, 1997).
Por otro lado, es bien conocido que la noradrenalina inhibe la liberación de CRH, formada en el núcleo paraventricular del hipotálamo y en el núcleo periventricular de la región preóptica-hipotálamo anterior. Por dicho motivo, no resulta ilógico el pensar que el incremento de los niveles de CRH en el líquido cefalorraquídeo (LCR) (Nemeroff y cols. , 1984), la disminución de sus lugares de fijación en la corteza frontal de víctimas de suicidio (Nemeroff y cols. , 1988) y la hipercortisolemia observada en los pacientes depresivos sea consecuente con una disminución del funcionalismo noradrenérgico a nivel central. En este sentido, se ha demostrado que la administración crónica de desipramina atenúa la activación del LC inducida por el estrés y regulada por la liberación de CRH endógena. Asimismo, la sertralina, también en tratamiento crónico, altera la descarga del LC de forma opuesta a la de la CRH (Valentino y cols. , 1990).
Estos resultados sugieren que la CRH puede provocar cambios adaptativos en la actividad TH de las neuronas adrenérgicas tras el estrés crónico y, por tanto, puede desempeñar un papel en la etiología de la depresión (Leonard, 1997a). De hecho, en los pacientes con depresión y concentraciones elevadas de CRH en el LCR, éstas se normalizan 24 horas después de un tratamiento electroconvulsivo. Estas observaciones indican que las anomalías observadas en la concentración de CRH en el LCR constituyen un marcador de estado.
Parámetros noradrenérgicos en fluidos biológicos
Aunque resulta aventurado extrapolar a nivel central los datos obtenidos a nivel periférico, se comentarán brevemente algunos datos, debido al mayor número de determinaciones que pueden realizarse de cualquier parámetro, a la homogeneidad de las muestras y, en definitiva, a la mayor fiabilidad (Tabla II).
TABLA II: Parámetros noradrenérgicos en fluidos biológicos de pacientes depresivos.
NMN (normetanefrina); MHPG (3-metoxi-4-hidroxifenilglicol); DHPG (3, 4-dihidroxifenilglicol)
(sin modificación); (aumento); (disminución).
Tomada de Alamo y cols. (2000).
Estudios en plasma
En la mayor parte de las investigaciones clínicas hasta ahora realizadas en pacientes depresivos se ha observado un incremento de la noradrenalina y normetanefrina plasmáticas, tanto en posición supina como erecta, y, particularmente, en los pacientes unipolares ansiosos o melancólicos y no supresores en la prueba de la dexametasona. Asimismo, empleando diversos paradigmas (ortostatismo, frío, etc. ), el aumento de los niveles plasmáticos de noradrenalina es mayor en el grupo de pacientes depresivos unipolares o bipolares que en el grupo control (Rudorfer y cols. , 1985).
Todos estos estudios hablan a favor de una disregulación de la noradrenalina en la enfermedad depresiva, que se traduce en un aumento de la actividad del sistema nervioso simpático periférico. No obstante, aunque la determinación de la noradrenalina plasmática ha sido ampliamente utilizada como índice funcional del sistema simpático por las ventajas que conlleva (fácil acceso, muestreo frecuente y control en diversas condiciones), muchos factores pueden alterar su aclaramiento plasmático. Por ejemplo, el aclaramiento plasmático de la noradrenalina disminuye en bipedestación, debido posiblemente a la disminución del gasto cardíaco y del flujo sanguíneo en los diversos órganos.
Resulta pues necesario considerar las posibles alteraciones en el aclaramiento de la noradrenalina al interpretar los cambios ocurridos en las concentraciones plasmáticas de catecolaminas. Por otra parte, la mayor fracción de la noradrenalina circulante deriva de la inervación simpática de las paredes vasculares, por lo que refleja el flujo regional. De ahí que el lugar de donde se obtiene la muestra sea un factor importante. Finalmente, existe una gran variabilidad intraindividual en los niveles plasmáticos de noradrenalina a diferentes tiempos, que no se puede solventar con determinaciones repetidas de este parámetro, ya que debido a su vida media tan corta (< 10 minutos) resulta difícil detectar pequeñas fluctuaciones en su concentración.
Para evitar estos inconvenientes, se ha realizado, recientemente, un estudio que ha permitido determinar la liberación de catecolaminas cerebrales, utilizando catéteres localizados en la vena yugular interna, tanto en voluntarios sanos como en pacientes depresivos no bipolares resistentes al tratamiento y tras la administración intravenosa de desipramina (Lambert y cols. , 2000). Los resultados de este estudio confirman una reducción del gradiente venoarterial de noradrenalina en los pacientes deprimidos (4, 0 2, 7 nmol/L vs. 0, 7 1, 3 nmol/L), y una posterior normalización tras el bloqueo farmacológico del transportador de noradrenalina con la desipramina. Estos resultados ponen de manifiesto la disregulación del funcionalismo noradrenérgico en los pacientes afectos de trastornos del humor.
Los estudios sobre niveles plasmáticos de MHPG, uno de los principales metabolitos de la noradrenalina en la especie humana, ha dado resultados muy variables (Goodwin y Jamison, 1990). En los pacientes depresivos unipolares estos niveles son, en general, similares a los de los controles. Sin embargo, las concentraciones plasmáticas de MHPG tienen tendencia a ser más bajas en los depresivos bipolares que en los unipolares (Siever y cols. , 1984; Goodwin y Jamison, 1990) y pueden ser más elevadas en los bipolares en fase maníaca que en fase depresiva (Halaris, 1978). Finalmente, los pacientes depresivos no supresores a la estimulación con dexametasona tienen concentraciones de MHPG en plasma relativamente mayores (Roy y cols. , 1986).
En los estudios publicados sobre niveles plasmáticos de 3, 4-dihidroxi-fenil-etilen-glicol (DHPG), precursor del MHPG, los resultados obtenidos han sido también contradictorios. En un estudio se observó una disminución en los pacientes depresivos (Scatton y cols. , 1986), mientras que en otro, publicado más recientemente, no se detectó diferencia alguna entre pacientes depresivos y controles (Healy y cols. , 1992).
Por último, destacar que en el estudio previamente comentado de Lambert y col. (2000), los gradientes de concentración venoarterial de MHPG y DHPG, determinados mediante un cateter situado en la vena yugular interna, estaban significativamente reducidos en los pacientes depresivos unipolares versus los voluntarios sanos.
Estudios en líquido cefalorraquídeo (LCR)
Como puede observarse en la tabla II, de seis estudios revisados por Potter y colaboradores (1993), en los que se han comparado las concentraciones de noradrenalina en LCR de pacientes depresivos con las de voluntarios sanos, en cuatro se detectó un aumento, en uno una disminución y en los otros dos ningún cambio significativo. La interpretación de estos resultados es difícil, ya que no se especificó si eran pacientes depresivos unipolares o bipolares (Leonard, 1997a).
Por su parte, los niveles de MHPG en el LCR de pacientes depresivos no difieren de los obtenidos en los controles, a excepción de un grupo de mujeres depresivas postmenopáusicas en las que se observaron niveles más elevados (Koslow y cols. , 1983). No obstante, si dentro del grupo depresivo se establecen subgrupos a tenor de la sintomatología o de la gravedad del trastorno, se observan algunas diferencias. Así, por ejemplo, los pacientes con una mayor ansiedad, agitación, somatización y trastornos del sueño tienen concentraciones más elevadas de MHPG en LCR (Redmon y cols. , 1986). Asimismo, se ha señalado que los niveles de MHPG en LCR de pacientes maníacos son más elevados que en los controles, mientras que los pacientes bipolares tipo I muestran una concentración menor a la obtenida en los pacientes unipolares (Potter y cols. , 1987).
Considerados conjuntamente todos estos resultados, se puede sugerir que la liberación de noradrenalina es mayor en la manía que en la depresión, y puede ser relativamente mayor en la depresión unipolar que en la bipolar (Potter y Manji, 1994).
Estudios en orina
La determinación de MHPG en orina de pacientes depresivos es posiblemente el parámetro bioquímico noradrenérgico que ha sido más estudiado (Filser y cols. , 1986; Potter y cols. , 1987). En un principio, se consideraba que aproximadamente un 50% del MHPG urinario provenía del SNC. En la actualidad, sin embargo, se estima que oscila alrededor de un 30%, al conocerse que el MHPG atraviesa con facilidad la barrera hematoencefálica (Kopin, 1985). Pero, independientemente del porcentaje de MHPG central en la orina, debido a la estrecha correlación entre el sistema noradrenérgico central y periférico, su determinación constituye teóricamente un índice importante de la función noradrenérgica central, aunque no provenga principalmente del SNC (Potter y Manji, 1994).
En los pacientes depresivos, se ha observado una ligera disminución en la excreción urinaria de MHPG en 24 horas, al ser comparada con la de los controles (Goodwin y Jamison, 1990). Esta modesta reducción aparece únicamente en los pacientes bipolares tipo I, pero no en los bipolares tipo II, aunque no todos los autores han confirmado esta observación (Davis y Bresnashan, 1987). Por el contrario, la excreción urinaria en los pacientes unipolares no está disminuida, habiéndose observado incluso un aumento en algunos pacientes (Schildkraut y cols. , 1978).
A tenor de estos últimos resultados, algunos investigadores han subdividido los pacientes unipolares basándose en los valores urinarios de MHPG, por considerar que este parámetro bioquímico constituía un factor de predicción de la respuesta al tratamiento (Maas y cols. , 1972). En efecto, en los trabajos inicialmente publicados se indicaba que un nivel urinario bajo de MHPG era predictor de una respuesta favorable a los antidepresivos que bloquean principalmente la recaptación de noradrenalina (desipramina, nortriptilina, maprotilina). Sin embargo, estudios posteriores han demostrado claramente que esta forma de pensar no era correcta.
Más recientemente, Schatzberg y cols. (1992) han observado que los pacientes con niveles urinarios bajos de MHPG respondían de forma más eficaz al tratamiento con fluoxetina que aquéllos que tenían niveles más elevados. En líneas generales, se puede afirmar que el MHPG urinario “per se” no se considera un índice aceptable para el diagnóstico o predicción de la respuesta al tratamiento.
La tendencia actual es determinar la concentración total de catecolaminas y de sus metabolitos en orina de 24 horas (Maas y cols. , 1987; Roy y cols. , 1988; Davis y cols. , 1988). Con esta forma de proceder, varios investigadores han observado un incremento en la excreción urinaria de noradrenalina y de su principal metabolito extraneuronal, la normetanefrina, en los pacientes depresivos.
Este hallazgo es aún más aparente cuando la excreción de noradrenalina y normetanefrina se cuantifica en relación a la excreción total de catecolaminas. Así, por ejemplo, en el estudio de Maas y cols. (1987), un aumento discreto en la excreción urinaria total de catecolaminas (16%) se acompañaba de un incremento manifiesto en la excreción urinaria de noradrenalina (57%) y de normetanefrina (42%) en los pacientes depresivos.
Estos resultados sugieren una mayor participación de las vías metabólicas extraneuronales y se correlacionan positivamente con los estudios plasmáticos, en los que, como antes se ha indicado, se observa un aumento de la liberación de noradrenalina. Potter y Manji (1994) han analizado recientemente los resultados obtenidos en más de una década de estudios llevados a cabo en su unidad del Instituto Nacional de Salud Mental de EE. UU. Estos autores compararon la excreción basal de noradrenalina urinaria y de sus metabolitos y la concentración extraneuronal de noradrenalina (NA+NMN/NA+NMN+MHPG+VMA) en pacientes depresivos unipolares y bipolares no medicados y en voluntarios sanos. Confirmando resultados previamente publicados, la noradrenalina urinaria, así como la fracción noradrenalina+normetanefrina urinaria estaban aumentadas en relación al “turnover” total en los pacientes depresivos en comparación con los voluntarios sanos.
Densidad y funcionalismo de los receptores adrenérgicos periféricos
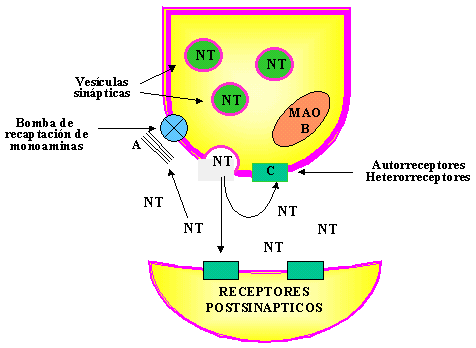
Dado que los receptores 2-adrenérgicos presinápticos modulan también la liberación de noradrenalina de las neuronas cerebrales, un gran número de autores ha considerado la posibilidad de que en la depresión exista un aumento de la densidad y/o de la sensibilidad de estos receptores. Para evaluar esta hipótesis se han utilizado diversas estrategias a nivel periférico, siendo las más frecuentemente empleadas la determinación de la densidad de los receptores alfa#61537; 2-adrenérgicos en plaquetas, por medio de radioligandos específicos y la evaluación funcional de estos receptores (García-Sevilla y cols. , 1990). Los resultados más representativos, en este sentido, se recogen en la tabla III.
TABLA III: Densidad y funcionalismo de los receptores adrenérgicos periféricos en pacientes depresivos.
(sin modificación); (aumento); (disminución).
Tomada de Alamo y cols. (2000).
De acuerdo con esta forma de proceder, en numerosos estudios se ha comparado la fijación de radioligandos específicos de los receptores 2-adrenérgicos (agonistas y antagonistas) en plaquetas de pacientes depresivos y de voluntarios sanos. En la mayor parte de los estudios en los que se ha utilizado la forma tritiada del antagonista alfa#61537; 2-adrenérgico yohimbina no se ha observado, en general, ninguna diferencia significativa en la fijación máxima (Bmax) a los receptores 2-adrenérgicos plaquetarios entre los pacientes depresivos y los controles (Piletz y cols. , 1986; Grossman y cols. , 1993). No obstante, en los estudios en los que se utilizaron agonistas parciales (clonidina, por ejemplo) o agonistas completos (UK-14, 304) se observó un aumento de la Bmax en las plaquetas de los pacientes depresivos (Piletz y cols. , 1986; Pandey y cols. , 1989; García-Sevilla y cols. , 1986 y 1990). Estos resultados han sido interpretados por algunos autores como una prueba evidente de que en la depresión existe una hipersensibilidad de los receptores 2-adrenérgicos (Piletz y cols. , 1986; García-Sevilla y cols. , 1986 y 1990). Sin embargo, no debe olvidarse que no todos los autores han obtenido resultados similares y que la clonidina, la p-aminoclonidina y el UK-14, 304, considerados previamente como ligandos selectivos de los receptores 2-adrenérgicos, también se fijan con elevada afinidad a los receptores imidazolínicos (Boyajian y Leslie, 1987; Meeley y cols. , 1989; Bricca y cols. , 1989). Por dicho motivo, el incremento de su fijación en los pacientes depresivos puede ser consecuente con el aumento de la densidad de los receptores imidazolínicos.
Por otra parte, los resultados obtenidos en algunos estudios en los que se ha evaluado la inhibición de la adenililciclasa plaquetaria por estimulación de los receptores alfa#61537; 2-adrenérgicos (adrenalina), sugieren una subsensibilidad de estos receptores en la depresión, aunque existen discrepancias en relación a este aspecto (Kafka y Paul, 1986; Pandey y cols. , 1990). En efecto, García-Sevilla y cols. (1990) han señalado que la agregación plaquetaria inducida por agonistas 2-adrenérgicos estaba aumentada en los pacientes depresivos. Por todo lo anteriormente expuesto, resulta aconsejable seguir profundizando en todos estos aspectos, con el fin de esclarecer los mecanismos fisiológicos implicados en las respuestas observadas.
La disminución de la densidad de los receptores adrenérgicos corticales y la reducción de la actividad adenililciclasa tras su estimulación, observadas en cerebro de roedores por la administración crónica de antidepresivos y electrochoques repetidos (Vetulani y Sulser, 1975; Charney y cols. , 1981b; Sugrue, 1983; Beer y cols. , 1987; Heal y cols. , 1989; Hosada y Duman, 1993) sugieren que estos cambios podrían estar relacionados con la eficacia clínica de estos tratamientos (Potter y Manji, 1994). De ahí que se considerara útil evaluar la densidad y funcionalismo de estos receptores en células mononucleares (linfocitos), tejido fácilmente accesible, con el fin de definir el papel de los receptores -adrenérgicos en la depresión y evaluar el efecto de los antidepresivos. No debe olvidarse, sin embargo, que los cambios en la densidad de los receptores alfa#61538; -adrenérgicos inducidos por los antidepresivos en la rata se restringen al subtipo 1 (Ordway y cols. , 1988), mientras que los linfocitos humanos contienen solamente el subtipo 2 (Meurs y cols. , 1982).
A pesar de estas consideraciones y de las limitaciones que representa el uso de los receptores de las células mononucleares, como modelo de los receptores cerebrales, muchos grupos han investigado la densidad de los receptores alfa#61538; -adrenérgicos en linfocitos de pacientes depresivos no sometidos a tratamiento. Los resultados obtenidos han sido, sin embargo, contradictorios (Tabla III). En efecto, muchos autores han detectado una disminución de la densidad de los receptores alfa#61538; -adrenérgicos (Pandey y Davis, 1986; Carstens y cols. , 1987; Magliozzi y cols. , 1989; Jeanningros y cols. , 1991), mientras que otros, han observado un aumento o ningún cambio (Sarai y cols. , 1982; Zohar y cols. , 1983; Healy y cols. , 1985; Mann y cols. , 1985; Cooper y cols. , 1985). Estos resultados opuestos pueden deberse a diferencias metodológicas (Werstiuk y cols. , 1990).
Sin embargo, los resultados han sido más consistentes cuando se ha investigado la actividad adenililciclasa consecuente con la estimulación de los receptores -adrenérgicos en linfocitos. En estas condiciones, se ha observado una disminución de la respuesta en los pacientes depresivos en comparación con los voluntarios sanos (Pandey y cols. , 1979; Mann y cols. , 1985). El mecanismo responsable de esta alteración no está por el momento aclarado, pero no debe descartarse, entre otras posibilidades, que el aumento de las catecolaminas y de los glucocorticoides circulantes pueden ejercer efectos significativos sobre la sensibilidad de los receptores -adrenérgicos (Werstiuk y cols. , 1990), posiblemente a través de sus efectos sobre las proteínas G estimulantes (GS) (Malbon, 1989).
Por todo lo anteriormente expuesto, resulta aconsejable realizar estudios adicionales con el fin de evaluar si las diferencias en la sensibilidad de los receptores -adrenérgicos linfocitarios observadas en la depresión constituyen un reflejo de lo que ocurre en el cerebro (Potter y Manji, 1994).
Estudios de depleción de monoaminas en el humano
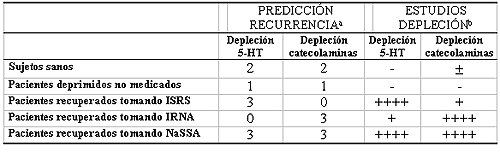
Para valorar la implicación de los diferentes sistemas de neurotransmisión monoaminérgicos en la depresión y en el mecanismo de acción de las diferentes familias de antidepresivos, se han realizado una serie de estudios de depleción de monoaminas (Delgado, 2000), en forma de ensayos doble-ciego, cruzados y comparativos con grupos control. Para ello, se seleccionaron pacientes depresivos y fueron tratados con agentes noradrenérgicos (desipramina o mazindol) o serotoninérgicos (fluoxetina o sertralina). Para efectuar la depleción de serotonina se recurrió a una dieta libre de triptófano y como agente deplecionante noradrenérgico se empleo -metil-p-tirosina (AMPT). Los controles se efectuaron midiendo los niveles plasmáticos de MHPG, ácido homovanílico y ácido hidroxi-indol-acético (metabolitos de la noradrenalina, la dopamina y la serotonina, respectivamente) y para valorar la recurrencia de los síntomas depresivos se utilizó la escala de Hamilton para la depresión (HDRS) (Delgado y cols. , 1998a).
Considerando la hipótesis monoaminérgica de la depresión, sería de esperar que la depleción serotoninérgica exacerbara los síntomas depresivos en los pacientes tratados con ISRS, mientras que la depleción de noradrenalina ocasionara un fenómeno parecido en los pacientes bajo tratamiento con desipramina (Tabla IV).
Sin embargo, los resultados obtenidos por el grupo de Delgado fueron bien distintos, como se refleja en la tabla IV.
Entre los pacientes con respuesta antidepresiva positiva a la desipramina, el riesgo de recaída tras la depleción con AMPT (50% de incremento en la puntuación de la escala HDRS) era mucho mayor que en el grupo de respuesta positiva a la fluoxetina (81% versus 19%) (Miller y cols. , 1996a). Del mismo modo, la depleción de triptófano ocasionó menos recaídas en pacientes con respuesta positiva a la desipramina (20%) que a los inhibidores selectivos de la recaptación




¿Por Qué es Esencial la Psiquiatría en la Cirugía Bariátrica? Impacto en Ansiedad, Depresión y Comportamiento Alimentario
Deldhy Nicolás Moya-Sánchez
Fecha Publicación: 28/12/2025
CAMBIOS CEREBRALES SECUNDARIOS A ESTRÉS CEREBRAL
Miguel Ponce Lopez
Fecha Publicación: 22/07/2025
La Avispa. El veneno que me salvó
Claudia Aceves
Fecha Publicación: 12/07/2025
Uso de antipsicóticos de 3ª generación en trastorno depresivo comórbido a consumo de cocaína
Blas Torrente Gutierrez
Fecha Publicación: 18/05/2025
Intervención con terapia de aceptación y compromiso en adolescentes: un estudio de caso
Valeria Patricia Villarino Hernández et. al
Fecha Publicación: 18/05/2025
Depresión mayor, a propósito de un caso
ASTRID MARÍA MORALES RIVERO et. al
Fecha Publicación: 18/05/2025