Repositorio de Artículos | Congreso Virtual Internacional de Psiquiatría, Psicología y Salud Mental (Interpsiquis) | IV Edición | 2003
Estrategias de potenciación mediante la asociación de antidepresivos.
Autor/autores: S. Ros Montalbán
Palabras clave: potenciación
Tipo de trabajo: Conferencia
Área temática: Depresión, Trastornos depresivos .
Estrategias de potenciación mediante la asociación de antidepresivos.
S. Ros Montalbán.
Consultor Señor, Servicio de psiquiatría, hospital del Mar, Barcelona.
Introducción
El concepto de depresión Resistente se origina hacia finales de la década de los 60, una vez completados la mayoría de estudios controlados con imipramina y Tricíclicos derivados.
Diversos autores entre ellos Kielholz 1979 (1), Freyhan 1974 (2), López-Ibor1971 (3) y Ayuso 1971 (4), detectaron casos de pacientes depresivos no respondientes a imipramina, que ocasionalmente respondían a tratamientos con clomipramina endovenosa o combinaciones orales de varios antidepresivos.
Haskovec y Rysanek 1967 (5) defendieron para estos casos el tratamiento asociado con reserpina, y obtuvieron buenos, aunque efímeros resultados.
Coppen 1963 (6) sugiere el termino de “potenciación” antidepresiva en pacientes resistentes, mediante la asociación de IMAO y Triptófano. La mayoría de estos autores consideran como resistencia la ausencia, de respuesta terapéutica a dosis medias de 150 mg de imipramina.
Quitkin 1985 (7) establece un primer criterio de resistencia:
- No respuesta a imipramina ( 300 mg oral, 24 h) o a un tricíclico equivalente.
- No respuesta a Fenelzina.
- No respuesta a terapia electroconvulsiva.
Revisiones posteriores de Fawcett y Kravitz 1985 (8) y Alvarez 1985 (9) establecen los criteros básicos de depresión Resistente:
- depresión Unipolar Primaria
- No respuesta a 300 mg de imipramina o tricíclico equivalente, ni a IMAO.
- Tiempo mínimo de espera de respuesta de 6 semanas.
- Buena cumplimentación del tratamiento (en ocasiones se aconseja la determinación de niveles plasmáticos).
Actualmente se tiende a establecer una gradación de resistencia: el número de ensayos antidepresivos que no han dado resultado, definirá los niveles de resistencia al tratamiento. La gravedad de la resistencia variará entre el fracaso de un ensayo antidepresivo y el de tres o más. Los ensayos antidepresivos han de realizarse con dosis correctas (modelo imipramina 150-300 mg), duración adecuada (6-8 semanas) y en base a los subtipos específicos de depresión (psicógena o endógena), Vallejo 2000. (10)
En una reciente revisión Paykel 1994 (11) concluye la dificultad para cifrar la incidencia exacta de depresión Refractaria, habida cuenta de la ausencia de estudios controlados y de criterios operativos consensuados. En general se acepta que un 15% de pacientes deprimidos unipolares permanecen clínicamente sintomáticos años después de ser tratados con psicofármacos específicos. Se considera como posible una tasa de depresión Resistente que oscila entre un 15 y un 30% de depresivos de distinta índole.
Se han propuesto algunos predictores de resistencia terapéutica en la depresión, como por ejemplo: edad avanzada, sexo femenino, enfermedades concomitantes, elevada neurosis, disfunción tiroidea, bajo apoyo social, tratamiento inadecuado, etc. Para Scott (12) una asociación especialmente maligna, paradigma de depresión Resistente sería la asociación de altos niveles de neurosis en pacientes con síntomas de depresión Endógena.
Tratamiento farmacológico de las depresiones resistentes
Una aproximación adecuada al problema de los límites de la depresión Resistente, obliga a la configuración de las verdaderas depresiones refractarias frente a otras consideradas como tales, sin serlo. Será necesario, en principio evaluar los posibles errores o deficiencias terapéuticas, ya que muchas depresiones consideradas resistentes, son atribuibles a ellos. Posteriormente ante el fracaso de los tratamientos básicos, se pueden poner en marcha toda una serie de estrategias que varían notablemente en función de los distintos clínicos.
Teniendo en cuenta que el orden no debe significar un apriorismo o, un criterio de mayor rango para alguna de las opciones, podemos sintetizar las estrategias terapéuticas de la depresión Resistente de la siguiente forma:
- Reevaluación del diagnóstico.
- Optimización del tratamiento
- Verificar dosis, duración del tratamiento, cumplimiento, niveles plasmáticos, etc.
- Comprobar si la indicación terapéutica es correcta
- Estrategias de potenciación farmacológicas
- Estrategias de combinación-asociación de dos o más antidepresivos
- Cambio de grupo farmacológico.
- Tratamientos experimentales farmacológicos
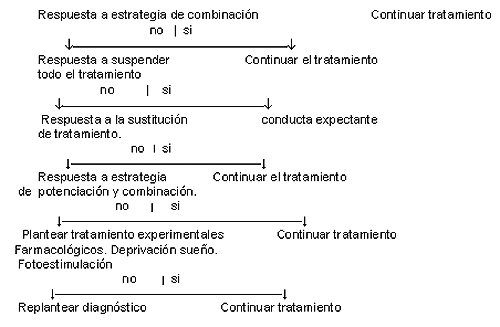
Vallejo J y Urretavizcaya M establecen un árbol de decisiones terapéuticas, interesante, que sin duda representa un guión práctico de actuación en el abordaje de la depresión Resistente (tabla 1).
Tabla 1 tratamiento FARMACOLÓGICO DE LAS DEPRESIONES RESISTENTES
Reevaluación diagnóstica y estrategias de optimización del tratamiento en las depresiones resistentes (Tabla 2)
· Antes de calificar un paciente como depresivo resistente deberá reconsiderarse el diagnóstico. Varias semanas después de evaluado el paciente y ante un mayor conocimiento clínico del mismo, deberá descartarse situaciones de comorbilidad psiquiátrica, o la existencia de situaciones médicas (trastorno del estado de ánimo secundario a enfermedad médica) que justifique la ausencia o insuficiencia de la mejora.
· En segundo lugar se comprobará el cumplimiento del tratamiento. Según algunos estudios el 70% de los pacientes psiquiátricos no cumplen correctamente el tratamiento médico. En el caso de los pacientes deprimidos, una actitud depresiva sobre el resultado del tratamiento, los efectos secundarios, o la existencia de otros problemas no detectados inicialmente, como la dependencia al alcohol o trastornos de la personalidad, favorecen el mal cumplimiento del tratamiento, Soler-Insa y Gascón 1999 (13).
· Confirmar que la dosificación es correcta. Gran parte de los pacientes depresivos resistentes al tratamiento, reciben dosis insuficientes, o tratamientos inferiores a 4-6 semanas que es el tiempo mínimo para valorar respuesta. En ocasiones el paciente al haber experimentado una mejoría, reduce la toma de medicación sin contar con el médico.
· Determinar si los niveles plasmáticos de antidepresivos son correctos. Ejemplo niveles en plasma de imipramina más desipramina han de ser superiores a 220 mg/ml. La concentración plasmática de un antidepresivo depende de su fracción no conjugada y varía, lógicamente, en función de la dosis, pero también depende de factores genéticos. Las variaciones sin relación con la dosis, entre individuos, oscila entre el 5-23%. El consumo de otros fármacos concomitantes puede alterar las concentraciones plasmáticas de los antidepresivos.
· Verificar si la indicación terapéutica es correcta. Se han considerado habitualmente efectivos:
- antidepresivos heterocíclicos como primera indicación en Depresiones Endógenas.
- antidepresivos IMAOs como primera indicación en Depresiones Atípicas.
- TEC más antidepresivos heterocíclicos como primera indicación en depresión Psicótica.
· Forzar tratamiento inicial.
- Dosis máximas recomendadas.
- Mayor duración del tratamiento inicial, llegando a 8-10 semanas sin plantear cambios terapéuticos
En determinadas circunstancias puede ser interesante el incremento de las dosis de antidepresivos por encima de la posología recomendada. Será necesaria realizar en el caso de los antidepresivos tricíclicos monitorización de los niveles plasmáticos, 5 días después de cada modificación de dosis. Hay que atender efectos adversos potencialmente peligrosos como alteraciones de la conducción cardíaca, riesgo de convulsiones y letalidad.
Guze 1987 (14), Ámsterdam 1989 (15), muestran la eficacia y seguridad de dosis altas de tranilcipromina (90-200 mg/día) en Depresiones Refractarías.
Hay un menor consenso en incrementar las dosis de ISRS. Algunos autores considerar más efectivo un tiempo de espera más amplio (ej. 8 semanas) antes que el aumento de las dosis recomendadas (ej. hasta 60 mg de Fluoxetina); Ámsterdam 1994 (16), Dornsief 1989 (17), Schweizer 1990 (18). Algunos estudios abiertos aconsejan no obstante incrementos de dosis; Fava 1992 (19).
Tabla 2 ESTRATEGIAS DE OPTIMIZACIÓN DEL tratamiento EN LA DEPRESIÓN RESISTENTE.
La relación dosis-respuesta en el tratamiento con venlafaxina y el incremento de la inhibición de la recaptación de noradrenalina hasta dosis de 225 mg/día y de dopamina hasta dosis de 500 mg, puede facilitar la opción de incrementar dosis en pacientes no respondedores a dosis más bajas. Nierenberg 1994 (20) describe un 40% de respuestas con altas dosis de venlafaxina (300-450 mg/día) en pacientes refractarios a otras estrategias terapéuticas (potenciación con litio, T3 y TEC). Es importante monitorizar la tensión arterial.
Estrategias de potenciación farmacológicas. (Tabla 3)
Consiste en añadir sustancias, sin actividad antidepresiva propia, que pueden “aumentar” la potencia del fármaco antidepresiva al que se adiciona.
Existen dos docenas de agentes antidepresivos que actúan por ocho mecanismos diferentes. Sin embargo existen pacientes que no responden al tratamiento inicial con uno u otro de los diferentes antidepresivos disponibles. Surge la posibilidad de la asociación de fármacos para el tratamiento de la depresión.
La estrategia más frecuente para tratar a los pacientes que no responden a varias monoterapias antidepresivas distintas consiste en ampliar el tratamiento con un segundo agente. Clásicamente estos casos resistentes al tratamiento se han abordado siguiendo algunos procedimientos estandarizados, es decir, probando primero con agentes individuales de distintas familias farmacológicas antidepresivas, y después potenciando dichos agentes individuales mediante la adición de un segundo fármaco, logrando así toda una serie de combinaciones farmacológicas. Los tres agentes potenciadores más estudiados han sido: litio, Hormona Tiroidea y buspirona.
Tabla 3 ESTRATEGIAS DE POTENCIACIÓN
LITIO.
Su uso empírico se remonta a 1980, cuando muchos estudios mostraron que la adicción de 600 mg/día de litio, dividida en varias dosis, con niveles plasmáticos correctos, permitía un incremento de la respuesta terapéutica en pacientes no respondedores a ADT, IMAOs o ISRS Price 1990 (21)Johnson 1991(22), Fein 1988 (23), Dinan 1993 (24), Baumann (25) 1996.
Prácticamente se ha asociado con todos los tratamientos antidepresivos de forma eficaz. Se hipotetiza su capacidad para aumentar la sensibilidad de los receptores serotoninérgicos postsinápticos, o sobre su posible acción sinérgica sobre los sistemas de segundos receptores.
El tiempo de latencia en la respuesta oscila entre las 24-28 horas, De Montigny 1981 (26) y las 3-6 semanas, Khan 1987 (27). No se explica esta variabilidad, si bien cuando más intenso y prolongado haya sido el tratamiento antidepresivo previo, menos posibilidad existe de una rápida respuesta a la potenciación con litio.
En conjunto se han publicado 11 estudios doble ciego, 10 de ellos con respuesta favorable a la asociación con litio; lo cual supone un total del 52% de una muestra de 135 pacientes; Fava 1994 (28); Joffe 1993 (29); Katona 1995 (30); Stein 1993 (31) y otros. Austin 1991(32) señala una tasa de respuesta a la potenciación con litio entre el 56 y 95%.
Variables como la edad, el sexo, el número de episodios, la gravedad de la depresión o la presencia de delirios; así como variables biológicas, no han demostrado capacidad predictiva. Vallejo 2000(33); Álvarez 1997 (34), apuntan como predictores de buena respuesta a potenciación con litio: la pérdida de peso significativa, retardo psicomotriz, disfunción del eje hipotalámico-adrenal y presencia en general de síntomas depresivos endógenos.
No se dispone de datos precisos entre grado de respuesta a la potenciación con litio y niveles plasmáticos del mismo. Podría ser suficiente niveles plasmáticos entre 0’4-0’6 meq/l; si bien litemías de 0’1-0’2 meq/l podrían ser eficaces en ancianos, Kushnir 1986(35). Es preciso monitorizar permanentemente los niveles de litio en sangre tras la semana de inicio, o ante cualquier modificación en la dosificación.
Parece probada la eficacia del litio en pacientes no respondedores a distintos tratamientos antidepresivos ¿Por qué no es utilizado en la frecuencia esperada? En primer lugar en 2 estudios; Fava 1994 (28), Katona 1995 (30); el litio mostró un bajo efecto antidepresivo al asociarse con ISRS. En segundo lugar ha de considerarse el riesgo de toxicidad del litio y su alta frecuencia de efectos secundarios, fundamentalmente en pacientes que presentaban buena tolerancia a los ISRS. La monitorización sanguínea, el riesgo de hipotiroidismo, el incremento de peso y de la neurotoxicidad, se han mostrado disuasorios en la utilidad del litio como agente potenciador.
TRIYODOTIRONINA (T3).
La enfermedad tiroidea se asocia fundamentalmente a las depresiones, especialmente en la mujer. El tratamiento de las alteraciones tiroideas pueden revertir la depresión. Se han observado algunas propiedades potenciadoras del efecto antidepresivo en pacientes no respondedores a tratamientos específicos de primera línea, al administrar hormona tiroidea suplementaria, aunque el paciente no presente hipotiroidismo manifiesto.
Hay 8 estudios controlados, doble ciego, que incluyen más de 200 pacientes en los que se compara T3 con placebo. En 6 de los 8 estudios, la T3 fue superior al placebo, Hatterer & Gorman 1990 (36); si bien este efecto parecía más significativo en la mujer.
Los estudios controlados de Prange 1969 (37) , Imipramina/hormona tiroidea versus placebo, y de Goodwin 1982 (38) en enfermedades refrectarias a imipramina y Amtriptilina observan un claro incremento de la respuesta antidepresiva y un menor tiempo de latencia en el inicio del efecto terapéutico, más frecuentemente en la mujer.
El metaanálisis de Aronson 1996 (39) con 292 pacientes confirma que la potenciación de tratamientos antidepresivos con Triyodotironina puede ser efectiva en un subgrupo de pacientes con depresión Refractaria.
En general disponemos de estudios con muestras muy pequeñas y generalmente referidas a ADT. Se disponen de escasos estudios con ISRS.
La dosis recomendada oscila entre 25-50 µg/día y la valoración de la respuesta se establece a la 3 semanas. Nunca se aconsejan tratamientos superiores a 8-12 semanas por el riesgo de hipotiroidismo asociado a la retirada.
Es frecuente la presencia de efectos secundarios como nerviosismo e insomnio asociados a esta estrategia de potenciación.
Existen pocos datos en relación a posibles efectos terapéuticos de la hormona T4, Prange 1996 (40), y no ha tenido una entidad relevante en clínica, probablemente por mayor dificultad de manejo que la T3.
BUSPIRONA.
La buspirona es un agonista parcial del receptor 5HTIA, con indicación principal en trastorno de ansiedad Generalizada, si bien se ha utilizado también como agente potenciador de la actividad serotoninérgica en depresión Resistente.
La buspirona actúa sinérgicamente con los ISRS; y en la medida en que la buspirona es un agonista parcial, y por tanto bloquea parcialmente los autoreceptores 5HTIA, puede actuar con mayor rapidez que los ISRS. El bloqueo de estos receptores los desinhibe inmediatamente, mientras que su estimulación provoca una desinhibición retardada debido al tiempo que necesitan para desensibilizarse. Además, a diferencia de los ISRS, cuyas acciones dependerán totalmente de la liberación endógena de serotonina, la buspirona no depende de los niveles de 5HT, ya que ejerce acciones directas en los receptores 5HTIA.
Joffe & Schuller 1993 (41) realizan un estudio prospectivo con una estrategia de potenciación, asociando 25/50mg/día de buspirona, durante 3 semanas a pacientes no respondedores a un ISRS (Fluoxetina o fluvoxamina durante 5 semanas de tratamiento) con resultados significativos (68% de respuestas).
Dimitriou 1998 (42), Jacobsen 1991 (43); obtienen buenos resultados utilizando 5-15 mg, dos veces al día, adicionando a un antidepresivo de primera línea en depresión Resistente.
Una posible ventaja de la buspirona como potenciador es que la adicción de este conjunto ha demostrado ser más efectivo que el placebo, en aliviar la disfunción sexual inducida por el tratamiento con ISRS.
Buspirona en resumen es una sustancia, bien tolerada, eficaz como tratamiento de potenciación en la depresión Resistente, y con un efecto ansiolítico interesante, dado que la ansiedad se asocia frecuentemente a la patología depresiva.
PINDOLOL.
Es una sustancia poco utilizada como potenciador de acción antidepresiva en USA, y relativamente más común en Europa y Canadá.
Es un bloqueador betaadrenérgico, que antagoniza además los autorreceptores 5HTIA presinápticos. Estudios preclínicos sugieren que pindolol puede desinhibir inmediatamente las neuronas serotoninérgicas, lo que ha hecho pensar que pudieran ser un antidepresivo de inicio rápido en sí mismo, acelerar el inicio de acción de los ISRS, o incrementar una respuesta insuficiente de los mismos.
En dosis de 2’5 mg/ 3 veces al día ha sido utilizado en distintos estudios asociados a ISRS, incrementando la respuesta antidepresiva en muchos, pero no en todos los estudios; Pérez V y Gilaberte I 1997 (44), Tome MB 1997 (45), Zanardi 1997 (46), Bordet 1997 (47) Y Blier 1998 (48). Un estudio de Moreno 1997 (49) no encuentra respuesta en 10 pacientes con depresión Resistente. Un estudio de Pérez V 1997 (44) no muestra diferencia con placebo en un estudio limitado a 10 días de potenciación, en una muestra de depresiones refractarias.
PRECURSORES DE LA SEROTONINA.
Tanto el Triptófano (L-TP) como el 5-Hidroxitriptófano (5HTP) se han utilizado en el tratamiento de la depresión con resultados contradictorios.
Parecen relevantes dos hechos:
a. El 5HTP puede tener una acción antidepresiva específica, e incluso profilácticas de recidivas, en aquellos depresivos que cursan con una disminución de 5-HIAA en LCR, Van Praag 1981(50), López-Ibor 1985(51), lo cual confirmaría la hipótesis serotoninérgica de la depresión.
b. Los precursores de la serotonina pueden facilitar fenómenos de potenciación farmacológica asociados a otros antidepresivos: IMAO Y clomipramina, Ayuso y Sáiz 1981 (52), Nolen 1985 (53) , y otros más específicamente serotoninérgicos, como la fluvoxamina, Kielholz 1986(54).
Un estudio de revisión de Nolen 1988 (55) de 6 estudios que implican precursores serotoninérgicos, no extrae conclusiones definitivas, dada la escasa rigorisidad de la metodología utilizada.
AGENTES CON ACTIVIDAD DOPAMINÉRGICA.
Algunos estudios han implicado directamente agentes dopaminérgicos en el tratamiento de la depresión Resistente. Podría considerarse una estrategia de potenciación interesante.
Bouckoms & Mangini 1993 (56) en un estudio abierto utilizan con éxito Pergolida (0’25-2 mg/día), sustancia con actividad antiparkinsoniana. Hay datos disponibles así mismo con Amantadina (100-200mg/2 veces al día) Michelson 2000 (57), y Pramipexol (0’125-0’25mg/3 veces al día) Sporn 2000 (58).
Recientemente un estudio prospectivo, abierto, con Pramipexol con dosis medias de 0’84mg/día asociado a ADT e ISRS mostró un 55% de respuestas favorables en 31 pacientes con Depresiones Unipolares o Bipolares, resistentes al antidepresivo de primera elección.
Históricamente otros trabajos han utilizado agentes dopaminérgicos con interés potenciador; Colonna 1979 (59) y Silverstone 1984 (60).
Desafortunadamente no existen estudios controlados, y las muestras son muy pequeñas, su efectividad es en este momento cuestionable.
Una ventaja interesante en este tipo de asociación farmacológica es la posibilidad de estimulación sexual de las sustancias con actividad dopaminérgica, evidenciable en modelos animales, lo que pudiera amortiguar la disfunción sexual inducida por los ISRS.
ANTIPSICÓTICOS.
Algunos trabajos han propuesto la administración de neurolépticos, y especialmente de reserpina, días antes del comienzo de un tratamiento antidepresivo, en un intento de elevar la sensibilidad de receptores postsinápticos, mejorando las expectativas de la respuesta antidepresiva, Poldinger 1981 (61), Kielholz 1986 (54).
La potenciación antidepresiva con reserpina (que depleciona las aminas biogenas en terminales nerviosas) en Depresiones Resistentes ha sido descrita por distintos estudios abiertos, Zohar 1991(62); si bien los resultados en estudios controlados han sido menos consistentes, Ámsterdam 1987 (63), Price 1987 (64). Empíricamente en la clínica cotidiana se han empleado asociaciones frecuentes de perfenacina y amitriptilina, perfenacina y nortriptilina, y Melitraceno más Flupentitxol entre otros, con respuestas aparentemente buenas en un subtipo de depresión Ansiosa considerada como más frecuentemente resistente.
Risperidona, Ostroff 1999 (65), y olanzapina Shelton 2001(66), han mostrado buena respuesta de potenciación, al asociarse a fluoxetina, con dosis de 0’5-2 mg de risperidona y 5-20 mg de olanzapina.
Previamente Ranjan y Meltzer 1995 (68) habían obtenido buenos resultados en Depresiones Psicóticas Refractarias.
La combinación de fluoxetina con olanzapina, produce un marcado incremento de los niveles de dopamina, serotonina y noradrenalina en el córtex prefrontal de las ratas, Zhang 2000(69). El rápido control de la ansiedad y la irritabilidad que se produce en esta asociación, la hace especialmente interesante en el tratamiento de la agitación y el insomnio en pacientes depresivos refractarios.
ANTICONVULSIVANTES.
Muchos de los anticonvulsivantes utilizados en el tratamiento del trastorno Bipolar (Ácido Vapróico, Valpromida, carbamacepina, lamotrigina, gabapentina y Topiramato) se han ensayado en el tratamiento de la depresión Resistente, Medina 1985(69), Small 1990 (70), Cullen 1991(71). No se dispone de estudios que avalen estas estrategias. Frecuentemente se asocian con sedación, y en el caso de Ácido Valpróico y Carbamazepina, aconsejan monitorización de niveles plasmáticos.
PSICOESTIMULANTES.
Los psicoestimulantes que tienen efectos significativos en la neurotransmisión dopaminérgica, han sido utilizados en maniobras de potenciación, asociados a ADT, IMAOs, ISRS e ISRN Wharton 1971(72), Fawcet 1991(73), Stoll 1996 (74), Lavretsky M 200 (75), Bader 1998 (76). Hay escasos estudios con muestras reducidas, diseñadas para valorar la eficacia de estas asociaciones.
Se han asociado habitualmente dextroanfetamina (5-20 mg/día) o metilfenidato (5-40 mg/día).
El metilfenidato puede actuar:
- Incrementando los niveles plasmáticos de los antidepresivos tricíclicos a los que se asocian.
- Activando el sistema dopaminérgico, más el efecto que producen sobre el sistema noradrenérgico y serotoninérgico.
Feighner 1985 (77) ha utilizado combinaciones de IMAOs, Tricíclicos y psicoestimulantes en 16 Depresiones Resistentes con mejora de la sintomatología depresiva en la mayoría de los casos.
Menza 2000 (78)ha utilizado modafinilo, un nuevo psicoestimulante con acciones farmacológicas algo distintas a las anfetaminas, con buenos resultados en Depresiones Resistentes a dosis de 200mg/día.
De Batista 2000 (79) en una muestra de 14 pacientes resistentes a tratamiento con ISRS o venlafaxina, observa un 57% de buena respuesta al adicionar dosis de hasta 400mg/día de modafinilo al tratamiento antidepresivo previo.
Efectos secundarios frecuentes con este tipo de asociación: hipertensión, ansiedad, irritabilidad, insomnio, y se ha descrito algún episodio maníaco. Existe un riesgo de abuso potencial en pacientes con historial previo de dependencia a sustancias psicotrópicas. Un inconveniente importante en su utilización es la relativa vida media corta de los psicoestimulantes en general.
HIERRO.
El hierro es un enzima esencial en la síntesis de monoaminas cerebrales.
Kung había propuesto la administración de hierro en Depresiones Resistentes con ferroprenia.
Poldinguer empíricamente observa respuestas súbitas en algunos depresivos resistentes, al añadir hierro al tratamiento antidepresivo de base.
ESTRÓGENOS.
Los estrógenos ejercen importantes efectos en el comportamiento al interaccionar con los receptores neuronales.
La alta prevalencia de trastornos depresivos en mujeres, la influencia del ciclo menstrual en las variaciones del humor, la posible asociación entre la disminución de hormonas circulantes en el postparto, y la alta prevalencia de alteraciones del estado de ánimo en ese periodo, y los cambios del humor paralelos a la administración de estrógenos en mujeres postmenopáusicas, han sugerido una implicación de la disminución de los niveles hormonales, (especialmente en mujeres postmenopáusicas) en la etiopatogenia o en la refractariedad de algunos cuadros depresivos; Vallejo 2000 (33).
Se han asociado ISRS con terapia sustitutoria de estrógenos en mujeres peri o postmenopáusicas refractarias al tratamiento con monoterapia antidepresiva.
Casos anecdóticos en la práctica clínica demuestran que algunas mujeres que responden a estrógenos, no responden a los antidepresivos, y otras mujeres que responden a la combinación de estrógenos más antidepresivos, no responden a estrógenos solos.
Dado que el estrógeno es en sí mismo un activador directo de la transcripción , es posible que actué sinérgicamente en el nivel genómico con la transcripción activada por los ISRS, para producir un resultado molecular mayor del que producirían los ISRS por si solos.
Klaiber y Holsboer 1979 (80) describen reducción sintomatologica en mujeres deprimidas a las que se les administra estrógenos.
Prange 1972 (81) observa un incremento en la rapidez de acción de pacientes en tratamiento con 150 mg de imipramina, así como un incremento de los niveles plasmáticos del antidepresivo (con efectos tóxicos al combinarse con 25-50 µg de etinilestradiol).
Se utilizan como preparados de elección los estrógenos naturales, Shapira 1985 (82) o los estrógenos sintéticos distintos al etinilestradiol, Price 1983 (83)
Otros planteamientos de potenciación en esta área han sido: evitar el uso cíclico de estrógenos/progestágenos, eliminar progestinas, añadir testosterona o añadir
Dihidroepiandrosterona (DHEA).
El DHEA es el mayor corticosteroide circulante en humanos. Tiene una función fisiológica poco clara. Es un precursor parcial de testosterona y estrógenos, y su metabolito, DHEA-S, probablemente tiene importantes funciones biológicas y ha sido implicado en la regulación del humor y en la sensación de bienestar.
Un pequeño estudio preliminar doble ciego, Wolkowitz 1999 (84), sugiere su uso como potenciador de antidepresivos en Depresiones Refractarias.
THR.
Hormona hipotalámica que despertó grandes expectativas, así como todo el eje hipotalámico-hipofisario-tiroideo en la génesis de la depresión.
Utilizado por Herrero 1982 (85), y posteriormente por Marangell 1997 (86) como modulador del humor y potenciador de los tratamientos antidepresivos en la depresión Refractaria.
ESTRATEGIAS ANTIGLUCOCORTICOIDEAS.
Se ha correlacionado frecuentemente la depresión con la activación del eje hipotalámico-hipofisario-adrenal. Algunos autores han evidenciado alteraciones de este eje (mayor hiperactividad) en pacientes con depresiones ansiosas, de peor pronóstico y refractarias a una mayor variedad de estrategias antidepresivas.
Desde 1991, diferentes trabajos han implicado fármacos antiglucocorticoideos (Ketoconazol, Aminoglutatimida, Metirapona) y en el tratamiento de la depresión, Murphy 1991 (87); Wolkowitz 1992 (88); Amsterdam 1994 (89), Gharidian 1995 (90); O'Dwyer 1995(91). En algunos de ellos, pero no en todos, se ha encontrado efectos antidepresivos en pacientes resistentes a medicación antidepresiva y a TEC.
Wolkowitz 1996 (92) en un estudio doble ciego, controlado con placebo, utilizando dosis de 400-800mg de Ketoconazol en pacientes deprimidos; 8 de ellos con hipercortisolemia, encontró una respuesta antidepresiva del 48% para el principio activo frente al 6’6% para el placebo. Otros trabajos han utilizado el Ketoconazol como potenciador de la tranilcipromina, Amsterdam 1994 (15), litio y Fenelzina Ravaris1994 (16)
Las dosis diarias utilizadas de Ketoconazol oscilan entre 300 y 1000mg/día. Pueden presentarse efectos indeseables como hepatotoxicidad e hipoadrenalismo.
En un contexto opuesto a la hipótesis anterior, algún autor describe efectos antidepresivos con altas dosis de Dexametasona, Beale 1995 (94); Dinan 1997 (95). Este efecto no se ha replicado en estudios controlados.
INOSITOL.
Se ha propuesto como causas de depresiones refractarias la deficiencia de Inositol, segundo mensajero, que no transmitiría de manera adecuada la señal presináptica. Estudios preclínicos sugieren que la modulación postsináptica del sistema del segundo mensajero (fosfatilinositol y AMP cíclico), podrían ser útiles en el tratamiento de la depresión.
A pesar de los primeros y anecdóticos resultados de la potenciación con dosis de hasta 12 gramos/día de inositol; un estudio reciente controlado doble ciego, no ha dado soporte a su utilización Nemets, 1999 (96).
OPIÁCEOS.
Hay escasa evidencia generalmente fundamentada en estudios pequeños que avalan el uso como potenciador de antidepresivo, de sustancias opiáceas asociada a los mismos. Se ha utilizado la Oxicodeina, la Oximorfina, Stoll 1999 (97) y la Buprenorfina , Bodkin 1995 (98). La carencia de estudios adecuados, y el potencial de abuso de estas sustancias, limitan su utilidad.
FOLATO Y S-ADENOSIN-METiONINA (SAME)
Algunos folatos, y en particular el metiltetrahidrofalato y el 5-adenosin-metionina (SAME), son sustancias implicadas en procesos de metilación cerebral, y se han descrito para ellas propiedades antidepresivas. Alpert 2000 (99), Splilmann 1996 (100). Un estudio abierto de hasta 30mg/día en pacientes refractarios a ISRS sugieren mejoras tras su asociación, Alpert 1999 (101) y un estudio reciente de Coppen y Bailey 2000 (102) placebo controlado que añadió 0'5mg/día de folato a fluoxetina, mejoró significativamente la clínica depresiva en mujeres, pero no en hombres, frente a fluoxetina y placebo. El estudio de Berlanga 1992 (103) muestra un inicio del efecto antidepresivo más precoz, cuando se adiciona SAME a imipramina frente a imipramina y placebo.
ÁCIDOS GRASOS OMEGA 3.
Dado el interés de los ácidos grasos omega 3 en el tratamiento del trastorno Bipolar Stoll 1999 (104); se ha incrementado su interés como potenciador de antidepresivos en el tratamiento de depresión Refractaria. Desafortunadamente no hay estudios publicados.
Estrategias de combinación-asociación de dos o más antidepresivos. tabla 4
Existen varias razones para el uso de asociaciones de dos antidepresivos. En primer lugar, ciertas asociaciones de antidepresivos pueden aprovechar sinergias farmacológicas y moleculares teóricas para potenciar la neurotransmisión monoaminérgica. En segundo lugar, algunas asociaciones de antidepresivos, cuentan con evidencias anecdóticas y empíricas de seguridad y eficacia, procedentes de la práctica clínica; sin embargo mientras que hay muchos estudios doble ciego de potenciación, hay escasos estudios doble ciego de asociación, reflejando la necesidad de futuras investigaciones en esta área.
Finalmente la idea de utilizar varios mecanismos farmacológicos simultáneamente en Depresiones Resistentes, es un planteamiento terapéutico reconocido en otras áreas de la medicina, como en el tratamiento de infecciones bacterianas resistentes, del cáncer, de infección del virus de la inmunodeficiencia humana, o en la hipertensión resistente.
No vamos a profundizar en esta área puesto que ya ha sido descrita en capítulos anteriores de esta monografía.
Tabla 4 ESTRATEGIAS COMBINACIÓN-ASOCIACIÓN
Estrategias de sustitución/cambio de grupo farmacológico
Algunos investigadores han sugerido cambios de un tipo de antidepresivos triclícos (ej. de una amina terciaria o agente serotoninérgico) a otro diferente (ej. amina secundaria o agente noradrenérgico), Wystrom 1987 (105).
Las justificaciones empíricas para estas estrategias son limitadas y parece que los pacientes que fracasan a una estrategia adecuada con ADT no responden a nuevos ADTs.
El cambio de un triciclíco por un ISRS ha sido descrito como eficaz en diversos estudios. Pacientes refractarios a ADT presentan un incremento en la respuesta terapéutica en un 50% de casos al modificar tratamiento a fluoxetina según han sido comunicado en dos estudios, Reimherr 1984 (106), Beasley 1990 (107). Resultados similares se obtuvieron al sustituir imipramina por paroxetina. De la misma manera pacientes refractarios a un primer intento con ISRS pueden manifestar cambios favorables al modificar tratamiento a un ADT. Aproximadamente la mitad de los pacientes refractarios a paroxetina responden a imipramina.
Tras el fracaso de un ISRS inicial, muchos clínicos optan por un fármaco alternativo de la misma clase. La literatura a este respecto, no contraindica esta práctica, aunque todos los estudios realizados son abiertos.
Sin duda la estrategia más popular en cuanto a grupo farmacológico en el tratamiento de la depresión Refractaria lo constituye el cambio de ADT o ISRS a IMAO. En un estudio abierto en pacientes refractarios a clomipramina Thase encuentra una respuesta a IMAOs de un 57%. Igualmente Nolen describe la eficacia de tranilcipromina y Brofaromina en pacientes resistentes a nortriptilina y maprotilina. La respuesta a tranilcipromina fue del 50%. Deben respetarse los periodos de lavado en la sustitución de:
Pueden considerarse también de interés, sustituciones a otros grupos farmacológicos de última generación tales como venlafaxina, mirtazapina y Nefazodona, aunque disponemos de escasa información al respeto.
26. De Montigny C, Grunberg F, Mayer A. Lithium induces rapid relief of depresión in tricyclic antidepressant drug non-responders. Br J Psychiatry 1981; 138: 252-256.
27. Khan MC, Wickham AE, Reed JV. Lithium versus placebo in acute depression: a clinical trial. In Clin Psychopharmacol 1987; 2: 47-54.
28. Fava M, Rosenbaum JF, McGrath PI. Lithium and tricyclic augmentation of fluoxetine treatment for resistant major depression: a double-blind, controlled study. Am J Psychiatry 1994, 151: 1372-1374.
29. Joffe RT, Levit AJ, Bagby RM. Predictors of response to lithium and triiodothyronine augmentation of antidepressants in tricyclic non-reponders. BR J Psychiatry 1993; 163: 574-578.
30. Kantona CL, Abou-Saleh MT, Harrison DA. Placebo-controlled trial of lithium augmentation of fluoxetine and lofepramine. Br J Psychiatry 1995; 166: 80-86.
31. Stein G, Bernadt M. lithium augmentation therapy in tricyclic-resistant depression: a controlled trial using lithium in low and normal doses. Br J Psychiatry 1993; 634-640.
32. Austin M-PV, Souza FGM, Goodwin GM. Lithium augmentation in antidepressant-resistant patients: a quantitative analysis. Br J Psichiatry 1991; 159: 510-514.
33. Vallejo J, Gastó C. Trastornos Afectivos: ansiedad y depresión. Ed. Masson, 2000.
34. Álvarez E, Pérez-Sola V, Pérez-Blanco J. Predicting outcome of lithium added to antidepressants in resistant depression. J Affect Dis, 1997; 42 (2-3): 179-186.
35. Kushnir SL. Lithium-antidepressant combinations in the treatment of depressed, physically ill geriatric patients. Am J Psychiatry 19886; 143: 378-379.
36. Hatterer JA, Gorman JM. Thyroid function in refractory depression. En: Roose SP, Glassman AH, eds. Treatment Strategies for Refractory Depression. Washington, DC: American Psychiatry Press, 1990.
37. Prange AJ Jr, Wilson IC, Rabon AM. Enhancement of imipramine antidepressant activity by thyroid hormone. Am J Psychiatry 1969, 126: 39-51.
38. Goodwin R, Prange A, Post R. Potentiation of antidepressant effects by L-triiodothyronine in tricyclic nonresponders. Am J Psychiatry 1982; 139 (1): 34-38.
39. Aronson R, Offman HJ, Joffe RT. Triiodothyronine Augmentation in the Treatment of Refractory Depression. A Meta-analysis. Arch gen Psychiatry 1996; 53; 842-848.
40. Prange AJ Jr. Novel uses of thyroid hormones in patients with affective disorders. Thyroid 1996; 6: 537-543.
41. Joffe RT, Schuller DR. An open study of buspirone augmentation of serotonin reuptake inhibitors in refractory depression. J Clin Psychiatry 1993; 54: 269-271.
42. Dimitriou EC, Dimitriou EC. Buspirone augmentation of antidepressant therapy. J Clin Psychopharmacol 1998; 18: 465-469.
43. Jacobsen FM. Possible augmentation of antidepressant response by buspirone. J Clin Psychiatry 1991; 52: 217-220.
44. Pérez V, Gilaberte I, Faries D. Randomized, double-blind, placebo-controlled trial of pindolol in combination with fluoxetine antidepressant treatment. Lancet 1997; 349: 1594-1597.
45. Tome MB, Isaac MT. Paroxetine and pindolol: a randomised trial serotoninergic autoreceptor blockade in the reduction of antidepressant latency. Int Clin Psychopharmacoly 1997; 12, 81-89.
46. Zanardi R, Artigas F, Franchini L. How long should pindolol be associated with paroxetine to improbé the antidepressant response? J Clin Psychopharmacol 1997; 17, 446-450.
47. Bordet R, Thomas P, Dupuis B. Effect of pindolol on onset of action of paroxetine in the treatment of major depression: intermediate analysis of a double-blind, placebo-controlled trial. Am J Psychiatry 1998; 155: 1346-1351.
48. Blier P, Bergeron R. The use of pindolol to potentiate antidepressant medication. J Clin Psychiatry 1998; 59 (suppl 5): 16-23, discussion 24-25.
49. Moreno F, Gelenberg AJ, Bachar K. pindolol augmentation of treatment-resistant depressed patients. J Clin Psychiatry 1997; 58: 437-439.
50. Praag H van. Management of depresión with serotonin precursors. Bio Psychiatry 1981; 16 (3): 291-310.
51. López-Ibor JJ, Sáiz J, Lobos J. Biological correlations of suicide and aggressivity in major depressions (with melancholia): 5-hidroxyindoleacetic acid and cortisol in cerebral spinal fluid, dexamethasone suppression test and terapeutic response to 5-hydroxytryptophane. Neuropsychobiology 1985; 14: 67-74.
52. Ayuso J, Sáiz J. Las depresiones. Madrid: Interamericana, 1981.
53. Nolen WA, Van de Putte J, Dijken WA. L-5HTP in depression resistant to reuptake inhibitors. An open comparative study with tranylcypromine. Br J Psychiatry 1985; 147: 16-22.
54. Kielholz P. Treatment for therapy-resistant depression. Psychopathology 1986b, 19 (suppl 2): 194-200.
55. Nolen WA, Van de Putte J, Dijken WA. Treatment strategy in depression. I. non-tricyclic and selective reuptake inhibitors in resistant depression: a double-blind partial crossover study on the effects of oxaprotiline and fluvoxamine. Acta Psychiatr Scand 1988a; 78: 668-675.
56. Bouckoms AJ, Mangini L. Pergolide: an antidepressant adjuvant for mood disorders? Psychopharmacol Bull1993; 29: 207-211.
57. Michelson D, Bancroft J, Targum S. Female sexual dysfunction associated with antidepressant administration: a randomised, placebo-controlled study of pharmacologic intervention. Am J Psychiatry 2000, 157:239-243.
58. Sporn J, Ghaemi SN, Sambur MR. Pramipexole augmentation in the treatment of unipolar and bipolar depression: a retrospective chart review. Ann Clin Psychiatry 2000; 12, 137-140.
59. Colonna L, Petit M, Lepine JP. Bromocriptine in affective disorders. J Affect Disord 1979; 1: 173-177.
60. Silverstone T. Response to bromocriptine distinguishes bipolar from unipolar depression . Lancet 1984; 1: 903-904.
61. Poldinger W. Progresos relativos a la terapéutica de la depresión. Valladolid: Conferencia XIV Congreso Nacional Sociedad Española de psiquiatría, 1981.
62. Zohar J, Kaplan Z, Ámsterdam JD. Reserpine augmentation in resistant depresión: a review. En: Amsterdam J, ed Refractory Depression. New York: Raven Press, 1991, 219-222.
63. Amsterdam J, Maislin G, Winokur A. Pituitary and adrenocortical responses to ovine corticotropin-releasing hormone stimulation test. Arch gen Psychiatry 1987, 44: 775-781.
64. Price LH, Charney DS, Heninger GR. Reserpine augmentation of desipramine in refractory depression: clinical and neurobiological effects. psychopharmacology 1987; 92:431-437.
65. Ostroff Rb, Nelson JC. Risperidone augmentation of selective serotonin reuptake inhibitors in major depression. J Clin Psychiatry 1999; 60:256-259.
66. Shelton RC, Tollefson GD, Tohen M. A novel augmentation strategy for treating resistant major depression. Am J Psychiatry 2001; 158: 131-134.
67. Ranjan R, Meltzer HY. Acute and Long-Term Effectiveness of Clozapine in Treatment-Resistant Psychotic Depression. Biol Psychiatry 1996, 40: 253-258.
68. Zhang W, Perry KW, Wong DT. Synergistic effects of olanzapine and other antipsychotic agents in combination with fluoxetine on norepinephrine and dopamine release in rat prefrontal cortex. neuropsychopharmacology 2000; 23, 250-263.
69. Medina A, Moreno M. La carbamacepina en el tratamiento de las depresiones resistentes. Rev Depto Psiq Fac Med Barc 1985; 12: 287-292.
70. Small JC. Anticonvulsants in affective disorders. Psychopharmacol Bull 1990; 26: 25-36.
71. Culllen M, Mitchell P, Brodaty H. Carbamazepine for treatment-resistant melancholia. J Clin Psychiatry 1991; 52: 472-476.
72. Wharton R, Perel J, Dayton P. A potential clinical use for methyphenidate with tricyclic antidepressants. Am J Psychiatry 1971; 127: 1619-1625.
73. Fawcett J, Kravitz HM, Zajecka J. CNS stimulant potentiation of monoamine oxidase inhibitors in treatment-refractory depression. J Clin Psychopharmacol 1991; 11: 127-132.
74. Stoll Al, Pillay SS, Dimond L. Methylphenidate Augmentation of Serotonin Selective Reuptake Inhibitors: A Case Series. J Clin Psychiatry 1996; 67: 72-76.
75. Lavretsky H, Kumar A. Methylphenidate augmentation of citalopram in elderly depressed patients. Presented at the 39th annual meeting of the American College of neuropsychopharmacology; Dec 10-14; 2000; San Juan, Puerto Rico.
76. Bader G, Hawley JM, Short DD. Venlafaxine augmentation with methylphenidate for treatment-refractory depression: a case report. J Clin Psychopharmacol a998; 18: 255-256.
77. Feighner JO, Herbstein J, Damlouji N. Combined MAOI, TCA, and direct stimulante therapy of treatment-resistant depression. J Clin Psychiatry 1985, 46: 206-209
78. Menza MA, Kaufman KR, Castellanos AM. Modafinil augmentation of antidepressant treatment in depression. J Clin Psychiatry 2000; 62: 378-381.
79. DeBattista C, Solvason HB, Flores BH. Modafinil as an adjunctive agent in the treatment of fatigue and hypersomnia associated with depression. Presented at the 39th annual meeting of the American College of neuropsychopharmacology; Dec 10-14, 2000; San Juan Puerto Rico.
80. Klaiber EL, Broverman DM, Vogel W. Estrogen therapy for severe persistent depression in women. Arch gen Psychiatry 1979; 36: 550-554.
81. Prange AJ. Estrogen may well affect response to antidepressant. JAMA 1972; 219: 143:144.
82. Shapira B, Oppenheim G, Zohar J. Lack of efficacy of estrogen supplementation to imipramina in resistant female depressive. Biol Psychiatry 1985; 20: 570-583.
83. Price WA, Giannini AJ. Antidepressant effects of estrogen. J Clin Psychiatry 1983; 140 (3): 318-322.
84. Wolkowitz OM, Reus VI, Keebler A. Double-blind treatment of major depression with dehydroepiandrosterone. Am J Psychiatry 1999; 156: 646-649.
85. Herrero L. Trastornos depresivos en la práctica clínica. Newsletter Psiq Hoechst Ibérica 1982.
86. Maranguell LB, George MS, Callahan AM. Effects of Intrathecal Thyrotropin-Releasing Hormone (Protirelin) in Refractory Depressed Patients. Arch gen Psychiatry 1997; 54: 214-222.
87. Murphy BEP, Dhar V, Ghadirian AM. Response to steroid suppression in major depression resistant to antidepressant therapy. J Clin Psychopharmacol 1991; 11: 121-126.
88. Wolkowitz OM. Prospective controlled studies of the behavioral and biological effects of exogenous corticosteroids. Psychoneuroendocrinology 1992; 19: 233-255.
89. Amsterdam JD, Maislin G, Potter L. Fluoxetine efficacy in treatment resistant depression. Prog Neuropsychopharmacol Biol Psychiatry 1994; 18: 243-261.
90. Ghadirian AM, Englesmann F, Dhar V. The psychotropic effects of inhibitors of steroid biosynthesis in depressed patients refractory to treatment. Boil. Psychiatry 1995; 37: 369-375.
91. O’Dwyer AM, Lightman SL, Marks MN. Treatment of major depression with metyrapone and hydrocortisone. J Affect Disord 1995; 33: 123-128.
92. Wolkowitz OM, Reus VI, Chan T. Antiglucocorticoid treatment of depression: a double-blind ketoconazole study. En revision, 1996.
93. Ravaris CL, Brinck-Johnses C, Elliot B. Clinical use of ketoconazole in hypocortisoluric depressives. Biol Psychiary 1994; 35: 679.
94. Beale MD, Arana GW. Dexamethasone for treatment of major depression in patients with bipolar disorder (carta). Am J Psychiatr 1995; 152: 959-960.
95. Dinan TG, Lavelle E, Cooney J. Dexamethasone augmentation in treatment-resistant depression. Acta Psychiatr Scand 1997; 95 (1): 58-61.
96. Nemets B, Mishory A, Levine J. Inositol addition does not improve depression in SSRI treatment failures. J Neural Transm 1999; 106: 795-798.
97. Stoll AL, Rueter S. Treatment augmentation with opiates in severe and refractory major depression (letter). Am J Psychiatry 1999; 156: 2017.
98. Bodkin JA, Zorrnberg GL, Lukas SE. Buprenorphine treatment of refractory depresión. J Clin Psychopharmacol 1995; 15: 49-57.
99. Alpert JE, Mischoulon D, Nierenberg AA. Nutrition and depression: focus on folate: Nutrition 2000; 16: 544-546.
100. Spilmann M, Fava M. S-adenosylmethionine (Ademetionine) in psychiatric disorders: historical prespective and current status. CNS Drugs 1996; 6: 416-425.
101. Alpert JE, Pingol MG, Rankin MA. Methylfolate as an adjunct in SSRI refractory depression. In: Syllabus ans Proceedings Summary of the 1999 Annual Meeting of the American Association; May 15-20, 1999; Washington, DC; No 75:32.
102. Coppen A, Bailey J. Enhancement of the antidepressant action of fluoxetine by folic acid: a randomised, placebo controlled trial. J Affect Disord 2000; 60: 121-130.
103. Berlanga C, Ortega-Soto HA, Ontiveros M. Efficacy of S-adenosyl-L-methionine in speeding the onset of actino of imipramine. Psychiatry Res 1992; 44: 257-262.
104. Stoll AL, Severus WE; Freemann MP. Omega 3 fatty acids in bipolar disorder: a preliminary double-blind, placebo-controlled trial (see comments). Arch gen Psychiatry 1999; 56: 407-412.
105. Nystrom C, Hallstrom T. Comparison between a serotonin and noradrenaline reuptake blocker in the treatment of depressed outpatients: A cross-over study. Acta Psychiatr Scand 1987; 75: 377-382.
106. Reimherr FW, Wood DR, Byerly B. Characteristics of responders to fluoxetine. Psychopharmacol Bull 1984; 20: 70-73.
107. Beasley CM Jr, Sayler ME, Cunninghan GE Fluoxetine in tricyclic refractory major depressive disorder. J Affect Disord 1990; 20: 193-200
IMPORTANTE: Algunos textos de esta ficha pueden haber sido generados partir de PDf original, puede sufrir variaciones de maquetación/interlineado, y omitir imágenes/tablas.



Articulos relacionados
-
Tratamiento farmacológico de la melancolía. Antonio Soto Loza
Fecha Publicación: 16/12/2011-
Tratamiento farmacológico de la melancolía. Antonio Soto Loza
Fecha Publicación: 16/12/2011-
Tratamiento farmacológico de la melancolía. Francisco Domínguez Belloso et. al
Fecha Publicación: 20/07/2011-
Estimulación magnética transcraneal repetitiva: una nueva intervención neurobiológica buscando un lugar en psiquiatría. A propósito de cinco casos. M. García et. al
Fecha Publicación: 11/05/2010-
Litio: otras indicaciones terapéuticas. B. Martín
Fecha Publicación: 01/01/2001-
Estimulación magnética transcraneal repetitiva: una nueva intervención neurobiológica buscando un lugar en psiquiatría. A propósito de cinco casos. M. Romera
Fecha Publicación: 02/02/1998
-
-
-
-
-



